
Bilet_1
.pdf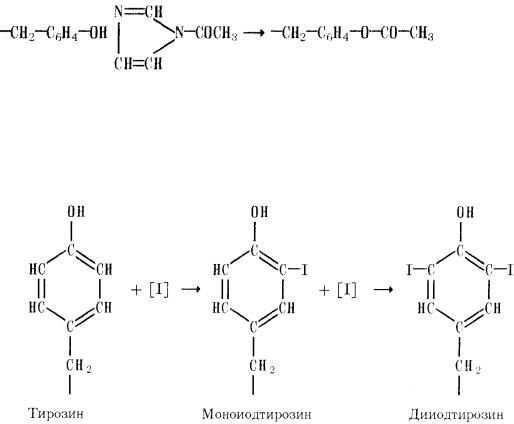
Если рибосомальная трансляция стандартным набором из 20 L-аминокислот,то нерибосомальные пептиды м. содержать необычные строительные блоки, включая D-аминокислоты, метилированные варианты стандартных аминокислот и непротеиногенные, гидроксилированные и гликозилированные остатки; сейчаст известно более 300 предшественников. Иногда пептидные продукты являются гетероцикличными, а пептидный остов м.б. разветвлен.
How are the peptides made? Нерибосомальные пептиды создаются на массивных линейных синтетазах. Эти энзимы являются модулярными, т.е. представлены серией функциональных единиц, которые м. связывать голые аминокислоты, активируя их как тиоэфир и присоединяя их к растущей пептидной цепочке. При линейных NRPSs, последовательности модулей действуют как матрицы, которые и предопределяют конечные последовательности пептидов. Но существуют также и повторяющиеся и нелинейные конфигурации NRPS, которые генерируют более сложные структуры.
Большинство NRP's модификаций являются преформированными во время синтеза или за счет сборки линейных компонентов, или внешними белками. Др. модификации м.б. добавлены после синтез. Некоторые синтетазы являются мультимерными комплексами, тогда как др. являются одиночными, массивными белками. Каждый модуль состоит примерно из 1,000-1,200 аминокислот, это делает энзимы ненормальными: одиночный в 15,281-остатков (1.7 MDa) белок, напр., синтезирует циклоспорин, иммуносупрессант в 11-остатков длиной.
Why is this important? NRPS продуцирует несколько фармакологически важных соединений, включая циклоспорин и антибиотики пенициллин и ванкомицин. Если исследователям удастся выяснить у пептидных синтетаз "генетическиий код," то они смогут манипулировать им, чтобы продуцировать новые соединения с лекарственными свойствами.
2. Химическая модификация остатков тирозина в белке, введение тиольной группы в остаток триптофана.
Гидроксильные группы тирозина в белках располагаются частично внутри, частично на поверхности белковой глобулы. В последнем случае для них характерен рКа>> 10, соответствующий
переходу:
-CH2-C6H4 –OH  -CH2-C6H4-O—
-CH2-C6H4-O—
Образующийся при этом фенолят-ион весьма активно вступает в реакции, свойственные также ε- аминогруппам лизина.
1)Ацилирование. Например присоединение ацетилимидазола.
2)Иодирование. Эту реакцию часто применяют как способ внедрения реактивных изотопов иода в белковую молекулу. Источником атомов иода может служить комплекс иода и йодистого калия; в некоторых случаях используют иод, образующийся при окислении иодид-иона в присутствии фермента пероксидазы. Иодирование приводит к образованию как моно-, так и дийодтирозина, причем замещение идет в о-положение:

3) Нитрование. Нитрование достигается действием тетранитрометана С(NO2)4 , причем в роли активной частицы обычно выступает нитроний-катион NO2+
Введение второй нитрогруппы возможно в о-положение.
4) Азосочетание. Реакция остатков тирозина с ароматическими солями диазония, также, являющимися катионными реагентами, опять-таки приводит к образованию моно- и ди-о-замещенных продуктов с достаточно протяженной системой сопряженных двойных связей, сто придает им красно-оранжевое окрашивание в реакции Паули (р-р белка смешивают со свежеприготовл. р-ром n-диазобензолсульфокислотой в присут. Na2CO3.) Эта реакция приводит к усилению кислотных свойств гидроксильной группы тирозина.
Введение тиольной метки в триптофан:
После этого нужна только обработка меркаптаном и вот тиольная группа уже радует глаз!
3. Убиквитинирование как механизм специфической деградации белков в клетке.
Убиквитинирование — это посттрансляционное присоединение ферментами убиквитинлигазами одного или нескольких мономеров убиквитина с помощью ковалентной связи к боковым аминогруппам белка-мишени. биквитин (от англ. ubiquitous — вездесущий) — небольшой консервативный белок, который у эукариот присоединяется к белкам. Присоединение убиквитина влияет на внутриклеточную локализацию и функцию белков. Самым первым открытием стала деградация белков, помеченных мультиубиквитиновыми цепями, с помощью 26S- протеасомы.

Протеасома построена из центрального кора, состоящего из 14 белковых димеров, по 7 в кольцевой структуре. Всего 4 кольца расположенных друг над другом; две регуляторные части с двух сторон от кора, 14 белков в каждой, 6 из которых ATP-
азы. Некоторые из субъединиц узнают убиквитин - белок, состоящий из 76 аминокислот. (рис.1).
рис.1 Схема протеасомы. Белок
подвергающийся протеолизу соединяется лизиновым остатком с С- концом убиквитина (рис.2),дополнительные молекулы убиквитина присоединяются формируя цепь, которая связываетя с регуляторной частью протеасомы. Степень убиквитинирования имеет
разные последствия для белка. Например, 48 остатков убиквитина присоединенные к белку служат сигналом протеасомного разрушения, тогда как 63 остатка служат посттрансляционным сигналом в различных клеточных процессах, таких как ДНК репарация, актвация транскрипционных факторов и др.
Рис.2 Схема присоединения убиквитина к белку и участие различных ферментов. Фермент Е1 активирует С-конец убиквитина, используя энергию АТФ, аденилированием и переносом тиоэфирной связи с цистеина на E1. Фермент Е1 переносит убиквитин к
транспортноми ферменту Е2, который при помощи Е3 лигазы присоединяет его к субстрату. Было обнаружено несколько генов кодирующих Е1, десятки генов Е2 и сотни Е3. Используя разные комбинации ферментов клетка регулирует какой белок должен быть разрушен и скорость распада. Развернутый белок перемещается в пространство коровой частицы, где специфически разрезается на короткие пептиды ~8 аминокислот, которые впоследствии могут быть разрушены пептидазами цитозоля.

Билет 15
1. Химическая модификация карбоксильных групп, остатков Tyr и Met в белках. Реакции карбоксильной группы:
1) Реакция с аминами в присутствии карбодиимидов (реакция Хоблина-Корано). Эту реакцию проводят в воде, используя водорастворимые карбодиимиды, например –этил-N-
триметиламинопропилкарбодиимид: С2H5 –N=C=N-CH2- CH2-+N(CH3)3I-
Реакция с этим или другими протекает по следующей схеме карбодиимид; R3-NH2-алифатический метиловый эфир глицина) – схема слева
Следует иметь в виду, что продукт активации карбоксильной группы- о- ацилизомочевинаможет не только вступать в реакцию с амином, но и стабилизироваться в результате
внутримолекулярного переноса ацильного остатка с атома кислорода на азот. Это приводит к образованию стабильной N-ацилмочевины:
2) Реакция с алифатическими диазосоединениями.
Стабильные |
алифатические |
|
диазосоединения, |
например |
|
производные |
диазоацетамида, |
в |
присутствии ионов меди реагируют с некоторыми карбоксильными группами, например с карбоксильной группой одного из остатков аспарагиновой кислоты :
3)Алкилирование карбоксильных групп. В качестве агентов, алкилирующих некоторые карбоксильные группы в белках, могут использоваться α-галоидкетоны, например р- бромфенацилбромид (Br-CH2CO-C6H4Br и его аналоги, а также галоидкислоты):
4)Гринкевич : можно восстановить карбоксильную группу до спиртовой с помощью B2H6.
5)Реакция этерификации. Эта реакция может использоваться для защиты карбоксильной группы при синтезе пептида.
6) Образование галогенангидридов с галогенидами фосфора (PCI5, РСl3) или тионилхлоридом (SOCI2). Реакция используется для активации карбоксильной группы при пептидном синтезе.

Химическая модификация остатков тирозина в белке
Гидроксильные группы тирозина в белках располагаются частично внутри, частично на поверхности белковой глобулы. В последнем случае для них характерен рКа>> 10, соответствующий переходу:
-CH2-C6H4-OH  -CH2-C6H4-O—
-CH2-C6H4-O—
Образующийся при этом фенолят-ион весьма активно вступает в реакции, свойственные также ε- аминогруппам лизина.
5)Ацилирование. Например присоединение ацетилимидазола.
6)Иодирование. Эту реакцию часто применяют как способ внедрения реактивных изотопов иода в белковую молекулу. Источником атомов иода может служить комплекс иода и йодистого калия; в некоторых случаях используют иод, образующийся при окислении иодид-иона в присутствии фермента пероксидазы. Иодирование приводит к образованию как моно-, так и дийодтирозина, причем замещение идет в о-положение:
7) Нитрование. Нитрование достигается действием тетранитрометана С(NO2)4 , причем в роли активной частицы обычно выступает нитроний-катион NO2+
Введение второй нитрогруппы возможно в о-положение.
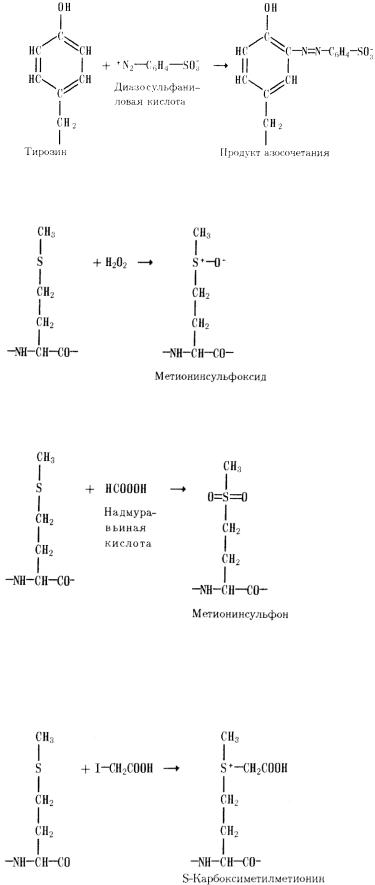
8) Азосочетание. Реакция остатков тирозина с ароматическими солями диазония, также, являющимися катионными реагентами, опять-таки приводит к образованию моно- и ди-о- замещенных продуктов с достаточно протяженной системой сопряженных двойных связей, сто придает им красно-оранжевое окрашивание в реакции Паули (р-р белка смешивают со свежеприготовл. р-ром n-диазобензолсульфокислотой в присут. Na2CO3.) Эта реакция приводит к усилению кислотных свойств гидроксильной группы тирозина.
Химическая модификация остатков метионина:
1) Остатки метионина в белках и особенно в пептидах легко окисляются до метионинсульфоксида:
В ряде случаев эта реакция протекает даже под действием кислорода воздуха. В более жестких условиях, например при действии надмуравьиной кислоты, окисление проходит глубже и приводит к метионинсульфону:
2) Для модифицирования остатков метионина чаще, однако применяют алкилирующие агенты или галоидзамещенные кислоты, в частности иодуксусную кислоту или ее амд. При этом характерно, что сера метионина реагирует с такого рода соединениями даже в слабокислой среде, когда большинство других нуклеофильных групп белка, в частности имидазольные группы гистидина, в реакцию не вступают, будучи протонированы:
2. Проблемы, связанные с анализом посттрансляционно модифицированных аминокислотных остатков в белках.
Во-первых, функционально активные центры, как правило содержат ансамбли групп, функциональные группы в необычном окружении, что изменяет, делает нестандартными их свойства, в результате чего возникают проблемы при идентификации модифицированного остатка

аминокислоты. В то же время следует учитывать еще одну трудность, внутренне присущую трактовке результатов, полученных любым методом модифицирования. Получив данные о том, что присоединение к некой группе белка заместителя R вызывает характерное изменение его функциональных свойств, например утрату активности, нелегко определить произошло ли это вследствие блокирования данной функциональной группы или же в результате введения остатка R в данную точку белка, где его присутствие недопустимо ( например, из-за вызываемых этим заместителем стерических осложнений). Расчет на то, что применение реагентов с очень небольшими радикалами R снимет проблему, вряд ли оправдан, так как помехи вовсе не обязательно связаны размерами. Это делает результаты хим. Модифицирования не всегда однозначными. За последние 20 лет, масс-спектрометрический анализ стал важным инструментом для определения видов и участков белковых модификаций. Масс-спектрометрический анализ может быть выполнен как для очищенных белков, так и для смеси белков, например, клеточных лизатов .
Другой способ –фосфорилирование радиоактивно меченным фосфором.
Гидроксилирование. Ярким примером является гидроксилирование Pro и Lys при образовании коллагена.
3. Пептидный синтез — это построение пептидной цепи путем соединения аминокислот с помощью химических методов. Обычно речь идет о получении пептидов, содержащих до 40 — 45 аминокислот, таким способом можно осуществить синтез и небольших белков.
Пептидный синтез служит надежным средством доказательства строения природных пептиднобелковых веществ. Синтетические пептиды широко используются для структурно-функциональных
исследований. С помощью химических методов удается получать аналоги биологически активных пептидов, в том числе циклические производные с заданными свойствами (например, с пролонги-
рованным, усиленным или избирательным действием), а также аналоги с остатками небелковых аминокислот. Синтетические пептидные фрагменты белков применяются для изучения их антигенных свойств и получения специфичных к отдельным участкам полипептидных цепей антител, используемых в структурно-функциональном анализе и в создании диагностикумов и вакцин. Методами пептидного синтеза получаются (в том числе и в промышленном масштабе) многие практически важные препараты для медицины и сельского хозяйства.

Защитные группы, используемые в пептидном синтезе
В пептидном синтезе существуют два типа защитных групп — постоянные и временные. Постоянными называют группировки, используемые для защиты боковых функциональных групп и удаляемые на заключительном этапе синтеза пептида.
Временными являются защитные группы для N-концевой аминогруппы и С-концевого карбоксила, снимаемые соответственно перед каждой стадией удлинения цепи или конденсации фрагментов.
Защитные группы, используемые в синтезе пептидов, должны удовлетворять следующим
условиям:
—полностью блокировать соответствующую группировку от участия в проводимых химических реакциях;
—быть устойчивыми в ходе удаления других защитных групп;
—не вызывать побочных реакций и рацемизации при введении, удалении и при образовании пептидных связей;
—защищенные производные должны быть устойчивыми идентифицируемыми соединениями;
—не вызывать осложнений с растворимостью и выделением пептидов из реакционных смесей.
Синтез на полимерном носителе. Пептидный синтез в классическом варианте сопряжен со значительными затратами труда и времени. С целью создания более эффективной методологии Р. Меррифилд в 1963 г. предложил твердофазный метод синтеза пептидов. Идея его состоит в закреплении растущей полипептидной цепи на полимерном нерастворимом носителе. При этом значительно упрощаются операции выделения промежуточных продуктов, которые сводятся к экстракции и фильтрованию полимера, полностью снимается проблема нерастворимости пептидов и создаются предпосылки для автоматизации процесса. Определяющим фактором в твердофазном синтезе является полнота протекания всех химических реакций, которая достигается за счет применения избытка конденсирующего агента и N-защищенной аминокислоты, отделяемых экстракцией. Естественно, выбор защитных группировок и методов конденсации должен обеспечить полное отсутствие рацемизации. Наилучшие результаты достигаются при использовании Вое-, Врос- и Fmoc-защитных групп, методов симметричных ангидридов и дициклогексилкарбодиимидного. Успешное проведение синтеза на твердом полимере требует применения высокоочищенных реагентов и растворителей на всех стадиях процесса. Первый твердофазный синтез гормона брадикинина был проведен Р. Меррифилдом с общим выходом 70%.
В качестве носителя наиболее широко используется микропористый хлорметилированный сополимер стирола и дивинилбензола, хорошо набухающий в органических растворителях и

обладающий химической и механической прочностью. Нагрузка полимера растущими пептидными цепями, как правило, невелика и составляет 0,1 — 0,3 ммоля пептида на 1 г полимера. Полнота реакции ацилирования оценивается на основании реакции с нингидрином или флуорескамином (см. с. 35 и 36) или физико-химическими методами.
С целью повышения кислотоустойчивости якорных группировок, связывающих пептид с полимером, в настоящее время применяются полимерные смолы с фенилацетамидометильными группами (Рат-полимеры).
Отщепление пептида от смолы проводится с помощью жидкого HF в присутствии анизола, раствора HF в пиридине, трифторметансульфокислоты, реактива Плесса [(CF3COO)3B в CF3COOH], а также HBr/CF3COOH и других реагентов; иногда применяется аммонолиз, гидразинолиз, омыление и т. п.
Автоматический твердофазный синтез пептидов осуществляется на специальных приборах, называемых синтезаторами. В последние годы создан колоночный
вариант твердофазного синтеза пептидов. В качестве матрицы вначале использовалась полярная полиамидная смола. Этот желатинообразный полимер хорошо проницаем и сольватируется многими растворителями, включая воду и диметилформамид. Мягкие полимеры такого типа в колоночном варианте имели неудовлетворительные физико-химические и механические свойства. Р. Шеппард и сотр. Предложили использовать жесткий макропористый неорганический носитель — силикагель, в порах которого заполимеризован полидиметилакриламидный гель. Этот носитель, сочетающий в себе свойства жесткой матрицы и хорошо набухающего органического геля, нашел успешное применение в колоночном твердофазном синтезе. На его основе создан и синтезатор колоночного типа.
