
- •Лекция 2
- •II.Репликация линейных молекул днк с внутренней инициацией и внесением разрыва в цепь. Репликация вирусов с линейными одноцепочечными днк
- •Самозатравочный механизм репликации аденоассоциированных парвавирусов
- •I Если на 5’-конце «заячьи уши» образовались до переноса шпильки на 3’-конце, то получается длинный продукт, содержащий два эквивалента генома. .
- •Автозатравочный механизм репликации автономных парвавирусов
- •Репликация вирусов с линейными двуцепочечными днк Poxviridae
- •III. Терминальная инициация репликации при помощи нуклеотид-белковой затравки Репликация вирусов с линейными двуцепочечными днк
Автозатравочный механизм репликации автономных парвавирусов
В вирионы включаются преимущественно (-) цепи ДНК. В отличие от аденоассоциированных вирусов концы различаются по структуре. На 5’-конце находится шпилька (1-206 нт, у вируса мышей), образованная из несовершенного палиндрома и, в принципе, возможна инверсия этого конца. На 3’-конце имеется шпилька (115 нт) с 11 неспаренными основаниями, тогда как у аденоассоциированных неспарено 7.

На 3’-концевой шпильке имеется очень важный для репликации участок, содержащий неспаренные основания. Из-за этого участка инверсии на 3’-конце не происходит. Таким образом, из-за того, что в вирионе находятся только (-) цепи ДНК и инверсия возможна только на 5’-конце, у автономных аденовирусов образуется только два варианта генома.
Репликация происходит по такому же механизму как у аденоассоциированных парвавирусов. Аналогом Rep-белка является полифункциональный белок NS I (non-structural). Он способен к димеризации, обладает ДНК-связывающей, эндонуклеазной и лигазной активностями, является также активатором транскрипции.
В активации эндонуклеазной активности как Rep, так и NS I могут участвовать клеточные белки. В этом случае таким белком является HMG ½ (High Mobility Group), который может взаимодействовать с NS I. TRS на 3’-конце узнается димером NS I, причем этот TRS должен быть в составе димера генома.
ААG
TTC
GA
CT PIF NS
I














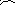









TRS
NS I связывается с двумя участками, аналогичными RBS и находящимися за динуклеотидом GA и тринуклеотидом AAG. К каждому такому участку примыкает TRS сайт. Спереди к динуклеотиду GA и тринуклеотиду AAG примыкает сайт для связывания димера клеточного транскрипционного фактора PIF (Parvovirus Initiation Factor). NS I вносит разрыв в TRS только в том случае, если он взаимодействует с PIF, а это происходит тогда, когда расстояние между ними два нуклеотида. То есть разрыв всегда вносится в участок вблизи GA, соответствующий 3’-концу мономера генома.
После внесения разрыва NS I остается ковалентно связанным с 5’-концом ДНК. 5’-конец получается длиннее, чем у исходной геномной молекулы. Считают, что при упаковке этот конец торчит из вириона. После заражения клетки довесок 5’-конца отщепляется, видимо, клеточными эндонуклеазами. Механизм неясен. Получается укороченная молекула. Однако не достает палиндромной части, которая потом может достроиться по 3’-концу клеточной полимеразой (???).

В конце следует отметить, что, несмотря на внешнее различие между механизмами репликации по типу катящегося рулона, между ними есть черты сходства. И в том и другом способе репликации в двуцепочечный участок ДНК вирусспецифический белок вносит однонитевой разрыв и ковалентно присоединяется к 5’-концу. 3’-конец служит затравкой для ДНК-полимеразы.
Репликация вирусов с линейными двуцепочечными днк Poxviridae
Представитель – вирус осповакцины. Вирусные частицы очень крупные в форме кирпича 350х270х100 нм. Имеет внешнюю липопротеидную оболочку. Геном представляет собой двуцепочечную ковалентно замкнутую на концах ДНК длиной – 191,5 тыс п.н. Концы представляют собой несовершенные палиндромы длиной ~100 нт, содержащие 15-20 неспаренных нуклеотидов. 4 неспаренных нуклеотида находится на самом конце, остальные внутри цепи. Так же как и у парвавирусов концы подвергаются инверсии.
Неполная комплементраность цепей и наличие инверсии концов позволяют предположить, что репликация поксвирусов происходит по схеме, описанной для парвавирусов. В пользу этого предположения указывает также тот факт, что вскоре после проникновения в клетку на конце молекулы как раз на границе концевой шпильки появляется разрыв, и далее в клетках обнаруживаются димеры генома. По общей структуре они аналогичны димерам, образующимся при репликации парвавирусов.

Возможно, димеры являются промежуточной стадией репликации генома поксвирусов. В таком случае должен существовать механизм образования мономеров геномов из димеров. Он существует и его можно изучать. Участок, содержащий место сочленения двух мономеров, можно вырезать и ввести в плазмиду, плазмидой трансформировать клетки, а затем определять условия, в которых происходит разъединение (resolution) концов с последующей линеаризацией плазмиды. Было установлено, что плазмида, содержащая исследуемый участок линеаризуется при инфекции клеток вирусом осповакцины, при этом концы линеризованной плазмиды становятся ковалентно-замкнутыми.

Каким образом делается разрыв в участке сочленения эквивалентов геномов? Наиболее вероятным представляется следующий способ. Поскольку концы представляют собой палиндромы, то в участке сочленения может образоваться крестообразная структура. Существуют специальные ферменты, узнающие и разрезающие подобные структуры, называемые структурами Холлидея. В данном случае действует, видимо, вирусспецифический фермент, поскольку плазмида линеаризуется только в присутствии вируса осповакцины. И такой фермент был обнаружен.

Видно, что некомплементарность в плечах структуры Холлидея не мешает ее разрешению. Возможно, разрезанию участка способствуют и клеточные белки. Недалеко от структуры Холлидея были обнаружены сайты для связывания клеточных транскрипционных факторов. Ранее мы уже встречались с подобной ситуацией, когда в репликации участвуют транскрипционные факторы. Видимо, используется их способность узнавать и связываться с определенными участками ДНК. Не факт, что в таком случае происходит транскрипция. Может быть, достаточно одного лишь взаимодействия транскрипционного фактора с этим участком ДНК, сопровождающимся локальными конформационными изменениями ДНК. Если транскриция и происходит, то может синтезироваться короткая бессмысленная РНК, лишенная старт-кодона. Может, нужен не продукт транскрипции и сам процесс. Так или иначе, при разрешении структуры Холлидея имеет место транскрипционная активация.
Таким образом, общая схема репликации вируса осповакцины выглядит так.

Особенностью репликации поксвирусов является то, что она происходит в цитоплазме, а не в ядре как у большинства ДНК-содержащих вирусов. В цитоплазме отсутствуют белки, участвующие в репликации ДНК, поэтому в геноме поксвирусов закодированы все необходимые для этого процесса белки: ДНК-полимераза и ее фактор процессивности – VPF, хеликазы, топоизомеразы, ДНК-лигазы, экзо- и эндонуклеазы и пр.
У поксвирусов и у парвавирусов описано два типа процесса элонгации репликации.

В геноме закодированы также другие ферменты, которые обязательны для репликации поксвирусов в некоторых случаях. В качестве примера можно привести урацил-ДНК-гликозилазу и dUTPазу. Первый фермент выщепляет из цепи ДНК ошибочно включенные остатки дезоксиуридиловой кислоты, второй – расщепляет дезоксиуридилтрифосфат, препятствуя включению этого нуклеозида в ДНК. Существуют такие же клеточные ферменты, но в достаточном количестве они присутствуют в делящихся клетках. В неделящихся же клетках вирусу приходится использовать собственные ферменты.
Довольно часто в репликации участвует целый комплекс ферментов, при этом между компонентами комплекса устанавливаются настолько тесные взаимодействия, что значительное повреждение одного из них, на первый взгляд, несущественного нарушает работу всего комплекса. Например, точковыми мутациями в гене урацил-ДНК-гликозилазы можно инактивировать фермент без нарушения репликации вируса, но делеция значительной части гена приводит к тому, что вирус прекращает размножаться. Видимо, фермент нужен для образования каких-либо белковых комплексов (функция scaffold белка). В общем случае ферменты часто образуют хорошо организованные комплексы.
Если в клетки, зараженные вирусом осповакцины внести любую кольцевую двуцепочечную молекулу ДНК, то в цитоплазме она начнет реплицироваться по схеме катящегося кольца. Видимо, у вируса есть все необходимые для этого белки, включая белок, вносящий разрывы в ДНК.
Для любых групп вирусов можно назвать имена исследователей внесших наиболее существенный вклад в их изучение. В случае поксвирусов – это Бернер Мосс. Недавно он опубликовал работу, в которой показал, что весь геном вируса осповакцины можно превратить в кольцевую форму и в виде плазмиды размножать в E. coli.
Группа иридовирусов
Подгруппа Iridopoxviridae.
Крупные икосаэдрические вирусы. Структура вириона отличная от поксвирусов, здесь икосаэдр – там кирпич. Геном линейная двуцепочечная ДНК длиной ~200 000 п.н. с замкнутыми концами. Наблюдается инверсия концов. Репликация проходит также в цитоплазме, для этого в геноме закодированы все необходимые ферменты.
У иридопоксвирусов было обнаружено, что существует ранняя ядерная стадия репликации. Образуются небольшие фрагменты ДНК, которые выходят из ядра в цитоплазму, где осуществляется полный цикл репликации.
