
- •Комплексные соединения в растворах.
- •Образование комплексного соединения
- •Ступенчатое образование комплексных ионов
- •Ступенчатая константа образования комплекса
- •Полные (суммарные) константы образования
- •Комплексные соединения в растворах
- •Диссоциация комплексных соединений. Константа нестойкости и константа образования (устойчивости)
- •Устойчивость комплексных соединений.
- •Суммарный процесс диссоциации внутренней сферы
- •Сравнение устойчивости аммиакатных комплексов
- •Хелат-эффект
- •Типы комплексных соединений.
- •Термическое разложение:
- •Гидроксокомплексы
- •Аммиакаты
- •Гидридокомплексы
- •Карбонилы металлов
- •Понятия о кислотах и основаниях
- •Кислоты и основания Бренстеда
- •Сопряженные кислоты и основания Бренстеда
- •Кислота и основание Льюиса
- •Кислоты и основания Льюиса
- •Кислотно-основное взаимодействие по теории Льюиса
- •Примеры кислот и оснований Льюиса
- ••Кислоты Льюиса - галогениды бора-
- •Кислоты Льюиса – галогениды алюминия
- •Примеры кислот и оснований Льюиса
- •«ЖЕСТКИЕ» И «МЯГКИЕ» КИСЛОТЫ И ОСНОВАНИЯ
- •Зависимости в изменении констант устойчивости комплексов с галогенид-ионами и подразделение на жесткие, мягкие
- •Сила кислот и оснований Льюиса
- •Жёсткие и мягкие кислоты и основания Льюиса
- •ЖЁСТКИЕ КИСЛОТЫ ЛЬЮИСА:
- •ЖЁСТКИЕ ОСНОВАНИЯ ЛЬЮИСА:
- •Сила кислот и оснований Льюиса
- •ПРИНЦИП «ЖЕСТКИХ» И «МЯГКИХ» КИСЛОТ И ОСНОВАНИЙ (ПРИНЦИП «ЖМКО»)
- •Кислотность и основность растворителей
- •Применение координационных (комплексных)
- •Применение координационных (комплексных)
- •К. Сайто, С. Хаякава и др. Химия и Периодическая
- •К. Сайто, С. Хаякава и др. Химия и Периодическая таблица,
- •Влияние радиуса катиона на устойчивость соединений щелочных металлов с криптандами
- •3. ПрименениеВ органическомко рдинационныхсинтезе соединений
- •Применение координационных (комплексных)
- •К. Сайто, С. Хаякава и др. Химия и Периодическая таблица, 1982
- •Литература

Сопряженные кислоты и основания Бренстеда

Кислота и основание Льюиса
Кислота – частица - акцептор электронной пары (H+, BF3, AlCl3, Ag+, Ni2+)
Основание – частица - донор электронной пары (OH , NH3, CO32 , CN , H2O)
AlCl3 |
+ |
:Cl |
|
[AlCl4] |
H+ |
+ |
:OH2 |
|
H3O+ |
Ag+ |
+ |
:CN |
|
[Ag(CN)2] |
Кислоты |
|
Основания |
|
|
Льюиса |
|
Льюиса |
|
|
значение теории Льюиса для координационной химии:
кислоты Льюиса – типичные комплексообразователи основания Льюиса – лиганды
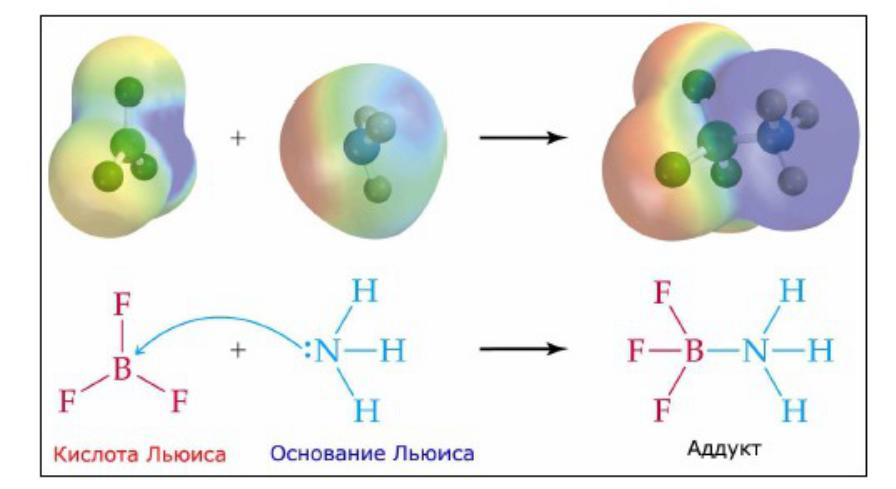
Кислоты и основания Льюиса
Акцептор |
Донор |
|
пары электронов |
||
пары электронов |
||
|

Кислотно-основное взаимодействие по теории Льюиса
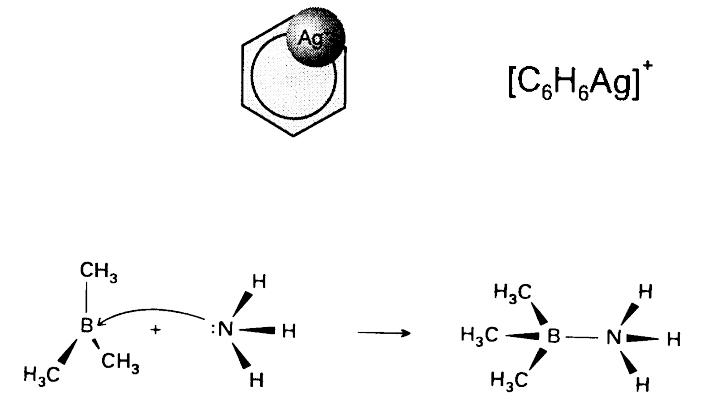
Примеры кислот и оснований Льюиса
•1. Катион (атом) металла – комплексообразователь в процессе образования комплексных соединений – кислота Льюиса, лиганд – основание Льюиса
•2. Молекулы с неполным электронным октетом – кислоты Льюиса
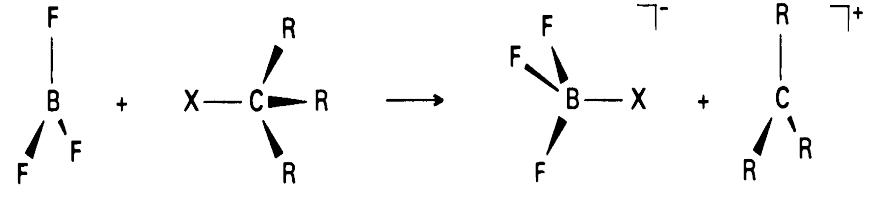
•Кислоты Льюиса - галогениды бора-
•BF3∙O(C2H5)2 – эфират трехфтористого бора -широко
используется в промышленности и в лаборатории в качестве кислотного катализатора (кислота Льюиса)
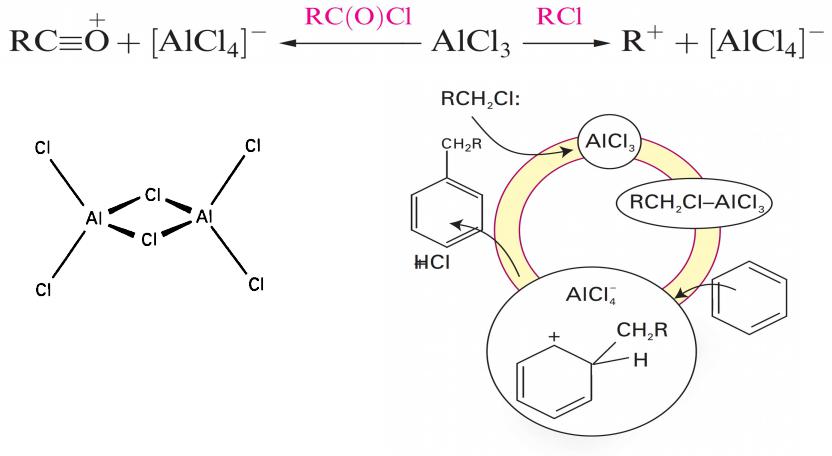
Кислоты Льюиса – галогениды алюминия
•Галогениды алюминия в газовой фазе – димеры; их растворы используют в качестве катализаторов Фриделя-Крафтса в реакциях алкилирования и ацилирования ароматических углеводородов.
Каталитический цикл реакции алкилирования Фриделя-Крафтса
Shriver and Atkins Inorganic Chemistry, 2010
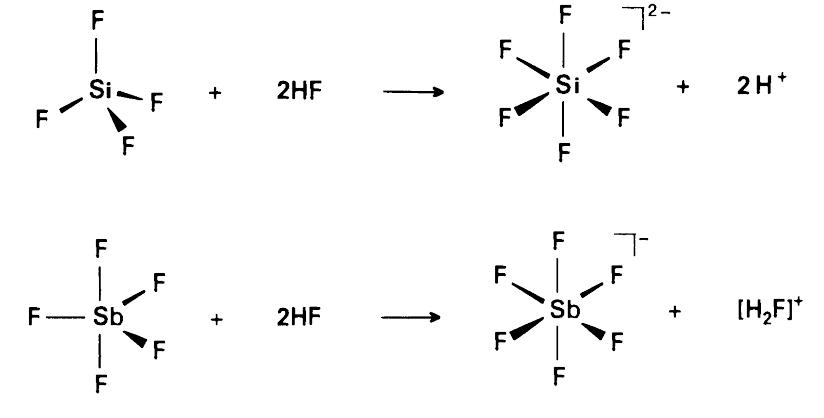
Примеры кислот и оснований Льюиса
•3. Молекулы или ионы, способные расширить электронную оболочку
«ЖЕСТКИЕ» И «МЯГКИЕ» КИСЛОТЫ И ОСНОВАНИЯ
все кислоты и основания Льюиса можно классифицировать
на жёсткие и мягкие
Соединения относят к тому или иному классу экспериментальным путем, измеряя константы образования комплексов с галогенид ионами в качестве лигандов:
Порядок изменения устойчивости комплексов [MLn]:
для жестких кислот
наиболее устойчивым является комплекс с фторид-ионом
I- < Br- < Cl- < F-
Порядок изменения устойчивости комплексов [MLn]:
для мягких кислот
наиболее устойчивым является комплекс с иодид-ионом
I- > Br- > Cl- > F-
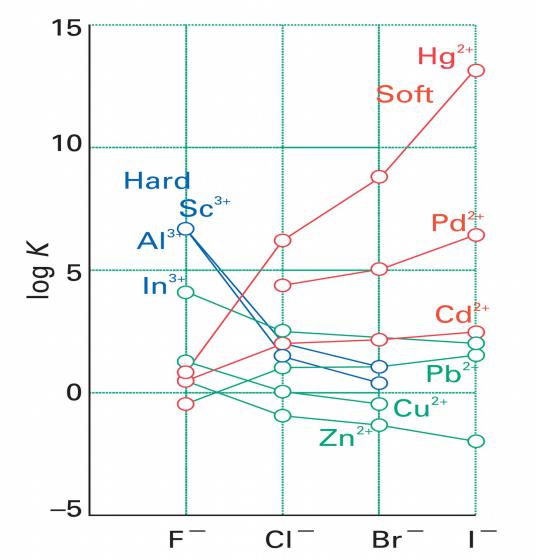
Зависимости в изменении констант устойчивости комплексов с галогенид-ионами и подразделение на жесткие, мягкие и промежуточные кислоты Льюиса
Жесткие кислоты (обозначены синим цветом) образуют более устойчивые комплексы с фторид-ионом; мягкие кислоты (обозначены красным
цветом) образуют более устойчивые комплексы с иодид-ионом; промежуточные - обозначены зеленым.
Shriver and Atkins Inorganic Chemistry, 2010
