
- •Строение атома
- •Ядерная модель атома
- •Постулаты Бора
- •Свет – электромагнитная волна
- •Виды излучений
- •Типы спектров
- •Спектральный анализ
- •Шкала электромагнитных волн
- •Инфракрасное излучение (тепловое)
- •Ультрафиолетовое излучение
- •Рентгеновские лучи
- •Модель атома водорода по Бору
- •Излучение атома водорода
- •Вынужденное излучение
- •Населенность уровней
- •Устройство рубинового лазера
- •Свойства лазерного излучения
- •Строение атомного ядра
- •Ядерные силы
- •Цепная реакция деления ядер урина
- •Неуправляемая цепная реакция
- •Управляемая цепная реакция
- •Радиоактивность
- •Виды радиоактивных излучений
- •Типы радиоактивного распада (правило смещения)
- •Закон радиоактивного распада
- •Экспериментальные методы регистрации заряженных частиц
- •Сцинтилляционный счетчик
- •Газоразрядный счетчик Гейгера
- •Получение радиоактивных изотопов
- •Биологическое действие радиоактивных излучений
- •Зарождение физики элементарных частиц
Модель атома водорода по Бору
В середине XVIII в.
Г.Кирхгоф обнаружил: свечение газов
дает четко выраженные дискретные линии.
Швейцарский преподаватель И.Бальмер
эмпирически вывел формулу для спектра
водорода (1885):
![]() ,
гдеn
– любое целое число >2, т.е. n
= 3, 4, 5 и т.д.
,
гдеn
– любое целое число >2, т.е. n
= 3, 4, 5 и т.д.
Так как
![]() ,
то
,
то![]() ,
гдеR
– постоянная Ридберга.
,
гдеR
– постоянная Ридберга.
Затем Ф. Пашен:
![]() n
= 4, 5, 6, ... (инфракрасное излучение),
n
= 4, 5, 6, ... (инфракрасное излучение),
Т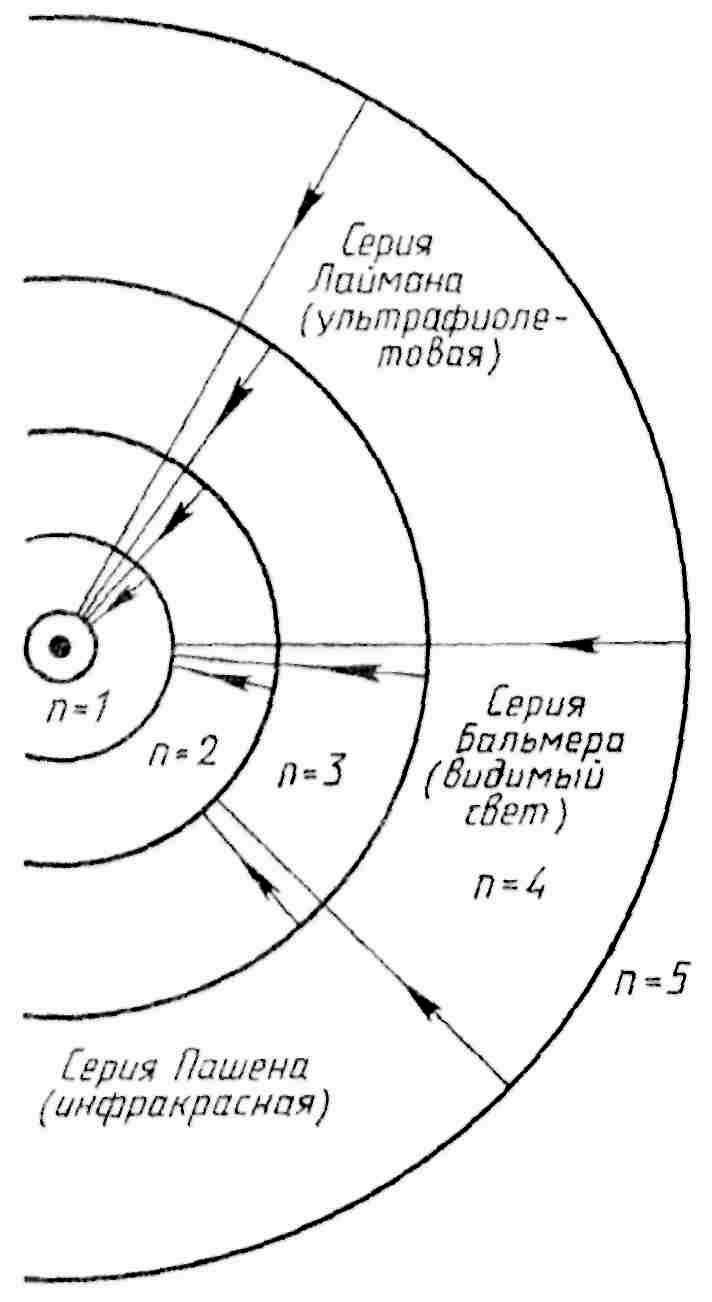 .
Лайман:
.
Лайман:![]() n
= 2, 3, 4, ... (ультрафиолетовое излучение).
n
= 2, 3, 4, ... (ультрафиолетовое излучение).
Значения длин волн спектральных линий, вычисленных по этим формулам, совпадали с исключительной точностью со значениями длин воли этих линий, измеренных экспериментально. В конце XIX в, ученые обнаружили фундаментальную закономерность в микромире, которую в то время объяснить не смогли. Только через 30 лет Н.Бор дал физическую интерпретацию этой формулы. Он предположил, что два члена в формуле Бальмера представляют собой полные энергии разрешенных орбит электрона в атоме водорода. Преобразовав формулу Бальмера (умножив обе части на hc), получим
![]() ,
,
![]() .
.
Свои постулаты Н.
Бор применил для построения теории
атома водорода: электроны могут двигаться
в атоме только по определенным орбитам,
которые определяются условиями:
![]() ,
,![]() ,
гдеrn
– радиус n-й
орбиты; vn
– скорость электрона на этой орбите;
me
– масса электрона; mevnrn
– момент импульса электрона; n
– целое число (n≠0).
,
гдеrn
– радиус n-й
орбиты; vn
– скорость электрона на этой орбите;
me
– масса электрона; mevnrn
– момент импульса электрона; n
– целое число (n≠0).
Энергия кванта раина разности энергий стационарных состояний электрона: hν= E2−E1.
На электрон со
стороны ядра действует кулоновская
сила (FK),
сообщая ему центростремительное
ускорение. Поэтому FK
= ma,
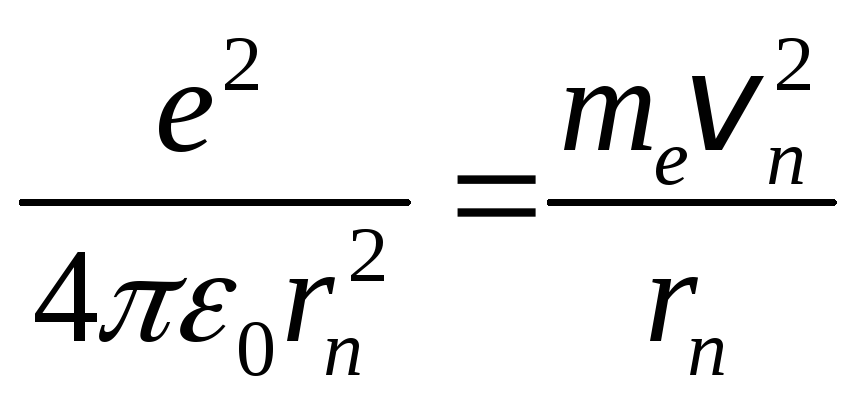 ,
,
![]() .
.
Подставляя уравнение для скорости электрона на орбите в предыдущее, получим
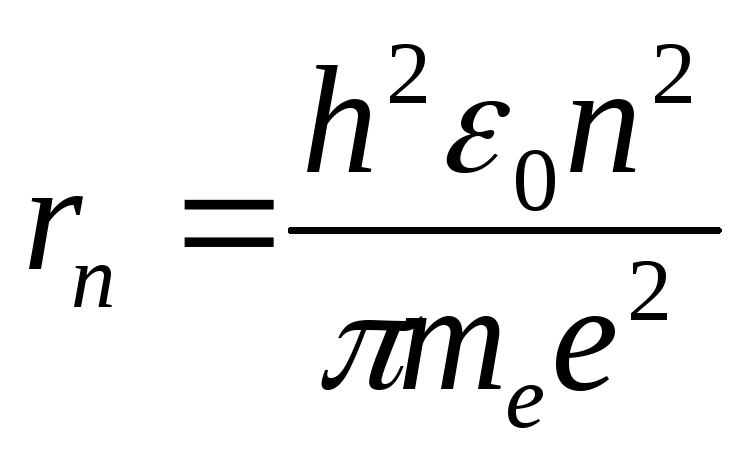 ,
где n
= 1, 2, 3, ...
,
где n
= 1, 2, 3, ...
Если n=1,
а r1≈0,5∙10−10
м, то r2
= r1n2
= 4 r1,
r3
= 9 r1
на основании r1:r2:r3,
как
![]()
Полная энергия
атома равна: Е
= Ек
+ Еп,
![]() ,
,![]() ,
,
![]()
П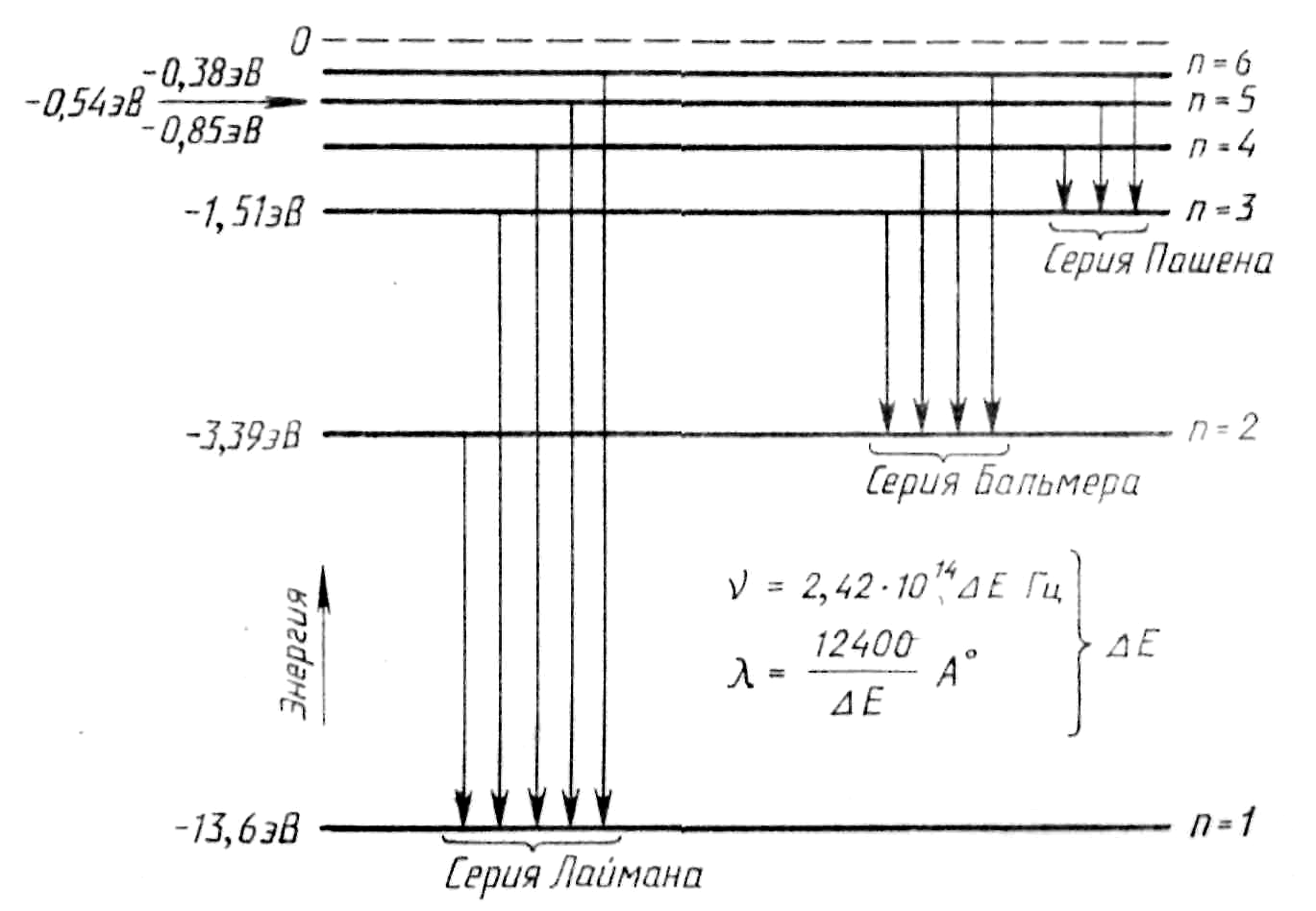 ереход
электрона с более высокой орбитыk
на орбиту n
сопровождается излучением фотона с
частотой:
ереход
электрона с более высокой орбитыk
на орбиту n
сопровождается излучением фотона с
частотой:
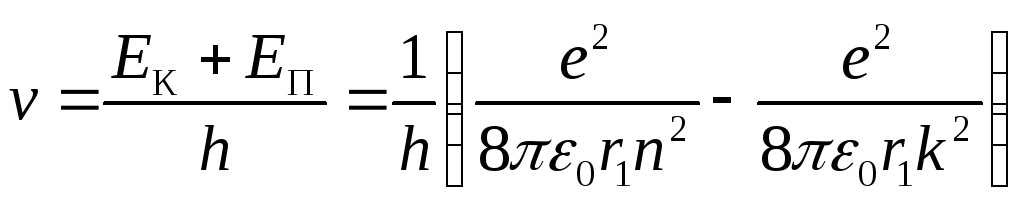 ,
,
![]() .
.
Таким образом, мы
пришли к формуле Бальмера, где
![]() .
.
Трудности теории Бора
Правило квантования Бора применимо не всегда. Представление об определенных орбитах, по которым движется электрон в атоме Бора, оказалось условным. Теория Бора неприменима для многоэлектронных атомов и не объясняет ряд спектральных закономерностей.
ОК-34
В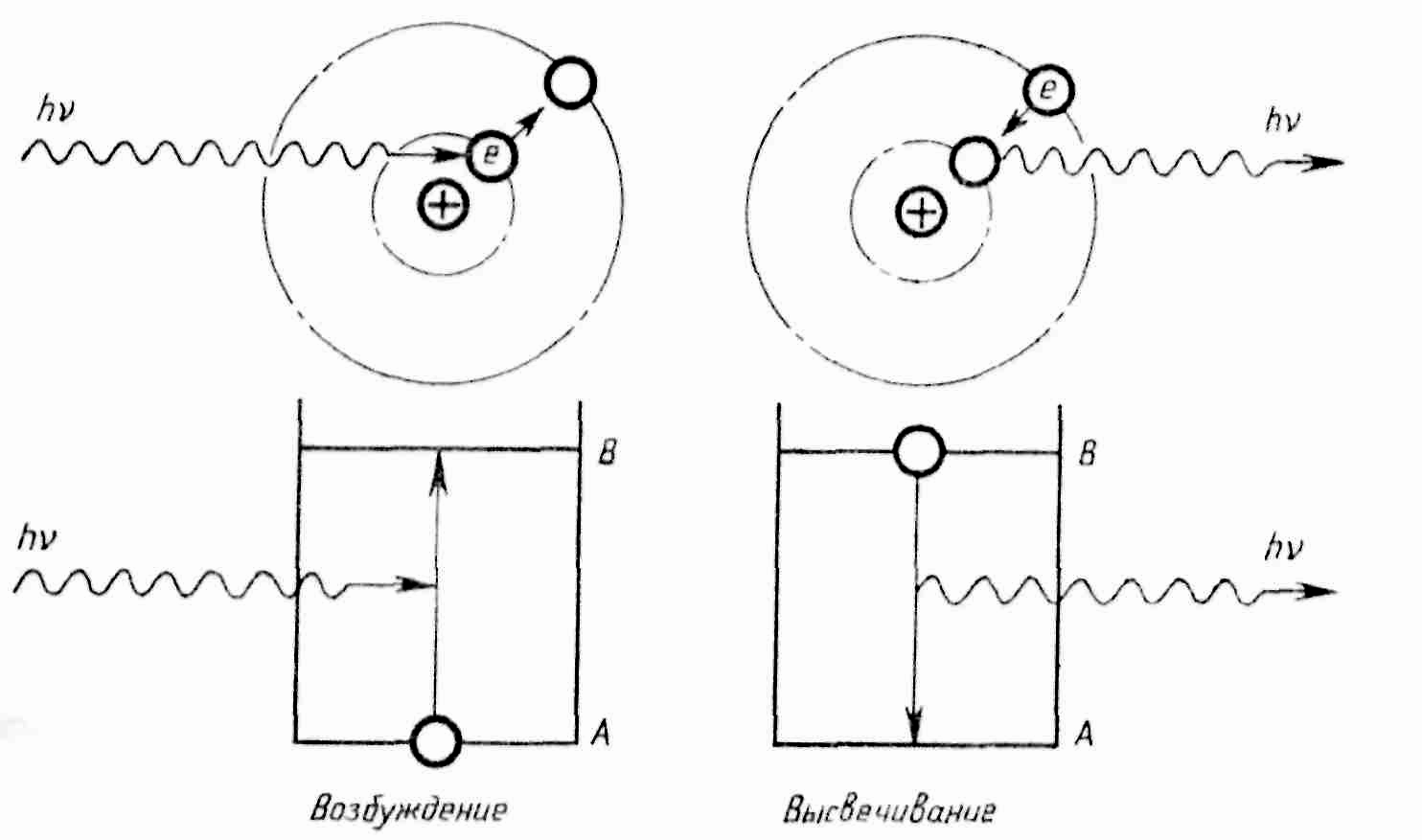 1917 г. А. Эйнштейн предсказал возможность
вынужденного излучения света атомами:
переход атома с высшего энергетического
состояния в низшее под влиянием внешнего
воздействия
1917 г. А. Эйнштейн предсказал возможность
вынужденного излучения света атомами:
переход атома с высшего энергетического
состояния в низшее под влиянием внешнего
воздействия
Излучение атома водорода
Фотон, имеющий энергию hν, возбуждает атом и переводит электрон в состояние с более высокой энергией. Электрон произвольно возвращается в первоначальное состояние, испуская фотон энергией hν.
Вынужденное излучение
П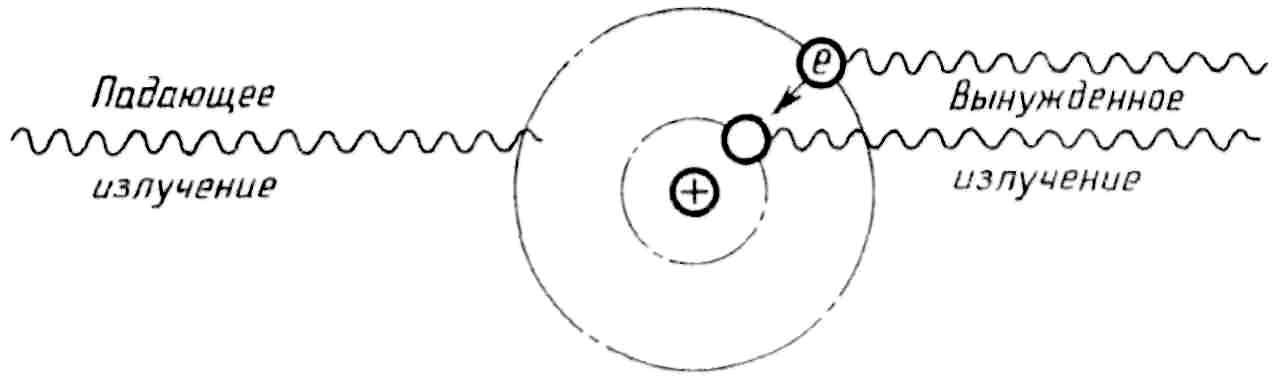 адающий
фотон с энергиейhν
взаимодействует с атомом, находящимся
в возбужденном состоянии, и стимулирует
его высвечивание. Возникают два фотона
с энергией hν
каждый, которые движутся в одном
направлении и одной фазе.
адающий
фотон с энергиейhν
взаимодействует с атомом, находящимся
в возбужденном состоянии, и стимулирует
его высвечивание. Возникают два фотона
с энергией hν
каждый, которые движутся в одном
направлении и одной фазе.
Населенность уровней
В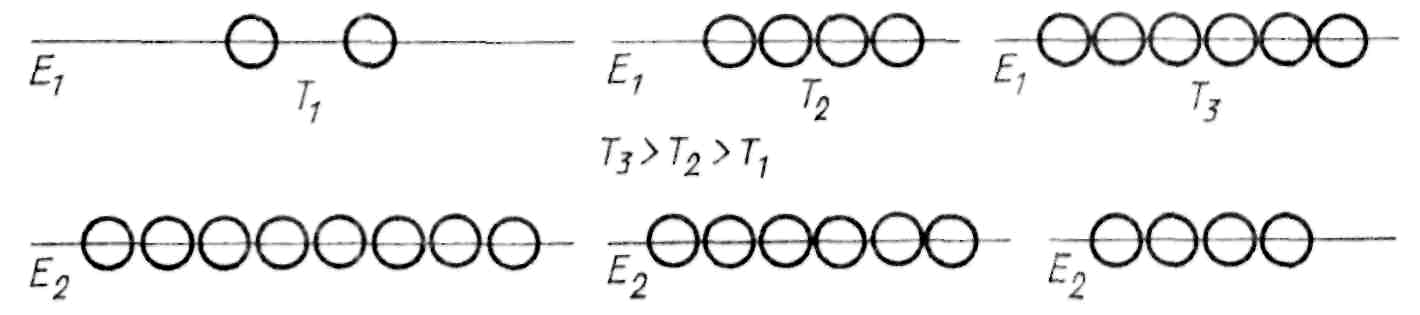 условиях теплового равновесия большая
часы, атомов обладает минимумом энергии,
населенность верхних уровней меньше
населенности нижних. Под влиянием
энергетических воздействий (повышение
температуры, освещение) возбуждение
атомов возрастает и населенность верхних
уровней увеличивается, но получить
распределение частиц по уровням, при
котором населенность верхних уровней
больше, чем нижних, таким способом
невозможно, так как увеличение населенности
верхних уровней способствует увеличению
спонтанных переходов на нижний уровень.
Атомы могут находиться в возбужденном
состоянии 10−8
с.
условиях теплового равновесия большая
часы, атомов обладает минимумом энергии,
населенность верхних уровней меньше
населенности нижних. Под влиянием
энергетических воздействий (повышение
температуры, освещение) возбуждение
атомов возрастает и населенность верхних
уровней увеличивается, но получить
распределение частиц по уровням, при
котором населенность верхних уровней
больше, чем нижних, таким способом
невозможно, так как увеличение населенности
верхних уровней способствует увеличению
спонтанных переходов на нижний уровень.
Атомы могут находиться в возбужденном
состоянии 10−8
с.
Ч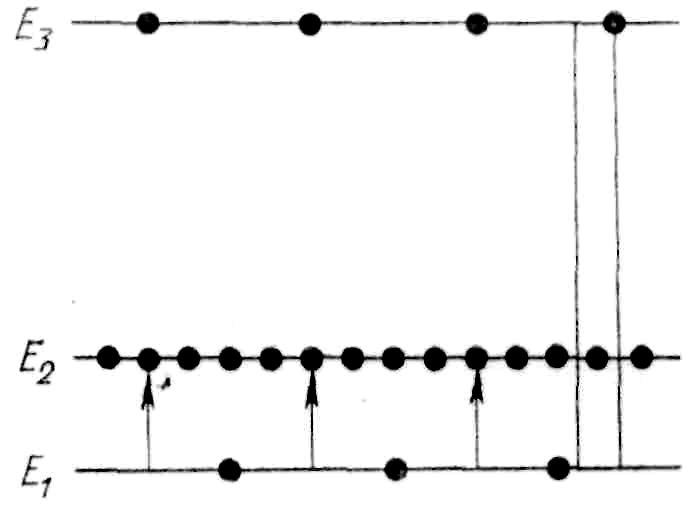 тобы
получить когерентное излучение в
результате вынужденного испускания,
необходимы два условия:
тобы
получить когерентное излучение в
результате вынужденного испускания,
необходимы два условия:
1. Населенность верхних уровней должна быть больше, чем нижних.
2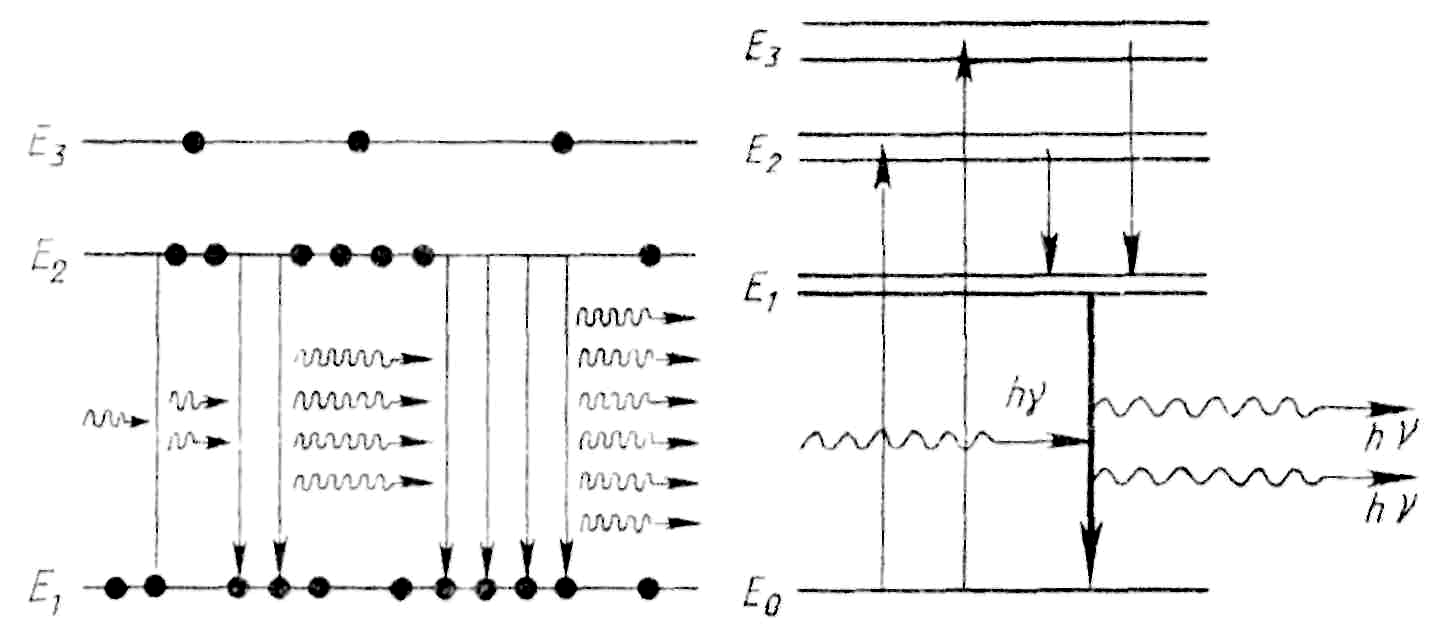 .
Один из верхних уровней с состоянием
E2
должен быть метастабильным, т.е. электроны
в нем должны находиться не 10−8
с, а порядка, 10−5
– 10−3,
с. Уровень с состоянием E2
мета-стабильный. Если вещество (например,
кристалл рубина) длительное время
освещать, то произойдет очень плотное
заселение метастабильных уровней. При
наличии уровня с состоянием E2
возможны спонтанные переходы из состояния
E3
не только в основное состояние E1,
но и на метастабильный уровень с
состоянием E2.
Оба перехода сопровождаются выделением
энергии. Большое различие во временах
жизни в состояниях E3
и Е2
приводит к тому, что под действием
возбуждающих фотонов с энергией hν≥E3–Е1
атомы переходят в состояние Е3,
а затем самопроизвольно – в состояние
Е2.
Без излучения света (энергия поглощается
кристаллом) и происходит накопление
атомов на метастабильном уровне с
состоянием E2.
Для создания в лазере инверсной
населенности используют Al2O3
смесь гелия (15%), неона (85%) и другие
вещества. Переход из состояния E2
в состояние E1
под действием внешней электромагнитной
волны сопровождается излучением, что
и используется в лазерах.
.
Один из верхних уровней с состоянием
E2
должен быть метастабильным, т.е. электроны
в нем должны находиться не 10−8
с, а порядка, 10−5
– 10−3,
с. Уровень с состоянием E2
мета-стабильный. Если вещество (например,
кристалл рубина) длительное время
освещать, то произойдет очень плотное
заселение метастабильных уровней. При
наличии уровня с состоянием E2
возможны спонтанные переходы из состояния
E3
не только в основное состояние E1,
но и на метастабильный уровень с
состоянием E2.
Оба перехода сопровождаются выделением
энергии. Большое различие во временах
жизни в состояниях E3
и Е2
приводит к тому, что под действием
возбуждающих фотонов с энергией hν≥E3–Е1
атомы переходят в состояние Е3,
а затем самопроизвольно – в состояние
Е2.
Без излучения света (энергия поглощается
кристаллом) и происходит накопление
атомов на метастабильном уровне с
состоянием E2.
Для создания в лазере инверсной
населенности используют Al2O3
смесь гелия (15%), неона (85%) и другие
вещества. Переход из состояния E2
в состояние E1
под действием внешней электромагнитной
волны сопровождается излучением, что
и используется в лазерах.
В 1940 г. В.А.Фабрикант указал на возможность использования вынужденного излучения для усиления электромагнитных волн.
Отечественные ученые Н.Г.Басов и А.М.Прохоров изобрели микроволновый генератор (лазер) (1954) и получили Нобелевскую премию.
Лазеры
Путем внешнего освещения возбужденные электроны из состояний E2 и E3 переходят в состояние E1, которое является рабочим состоянием лазера.
Лазерное излучение может быть различного цвета.
Рубиновый лазер генерирует пучок фотонов (λ = 694 нм) рубиново-красного света.
