
- •Строение атома
- •Ядерная модель атома
- •Постулаты Бора
- •Свет – электромагнитная волна
- •Виды излучений
- •Типы спектров
- •Спектральный анализ
- •Шкала электромагнитных волн
- •Инфракрасное излучение (тепловое)
- •Ультрафиолетовое излучение
- •Рентгеновские лучи
- •Модель атома водорода по Бору
- •Излучение атома водорода
- •Вынужденное излучение
- •Населенность уровней
- •Устройство рубинового лазера
- •Свойства лазерного излучения
- •Строение атомного ядра
- •Ядерные силы
- •Цепная реакция деления ядер урина
- •Неуправляемая цепная реакция
- •Управляемая цепная реакция
- •Радиоактивность
- •Виды радиоактивных излучений
- •Типы радиоактивного распада (правило смещения)
- •Закон радиоактивного распада
- •Экспериментальные методы регистрации заряженных частиц
- •Сцинтилляционный счетчик
- •Газоразрядный счетчик Гейгера
- •Получение радиоактивных изотопов
- •Биологическое действие радиоактивных излучений
- •Зарождение физики элементарных частиц
ОК-30
Строение атома
Г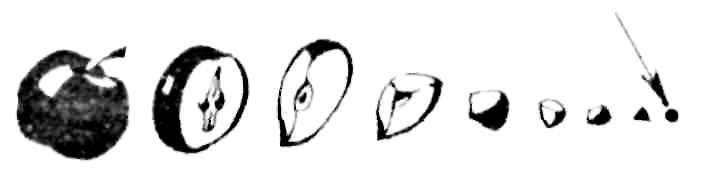 ипотеза
о том, что все вещества состоя! из большого
числа атомов, зародилась свыше двух
тысячелетий тому назад. Сторонники
атомистической теории рассматривали
атом как мельчайшую неделимую частицу
и считали, что все многообразие мира
есть не что иное, как сочетание неизменных
частиц – атомов.
ипотеза
о том, что все вещества состоя! из большого
числа атомов, зародилась свыше двух
тысячелетий тому назад. Сторонники
атомистической теории рассматривали
атом как мельчайшую неделимую частицу
и считали, что все многообразие мира
есть не что иное, как сочетание неизменных
частиц – атомов.
Демокрит: существует предел деления атома.
Аристотель: делимость вещества бесконечна
П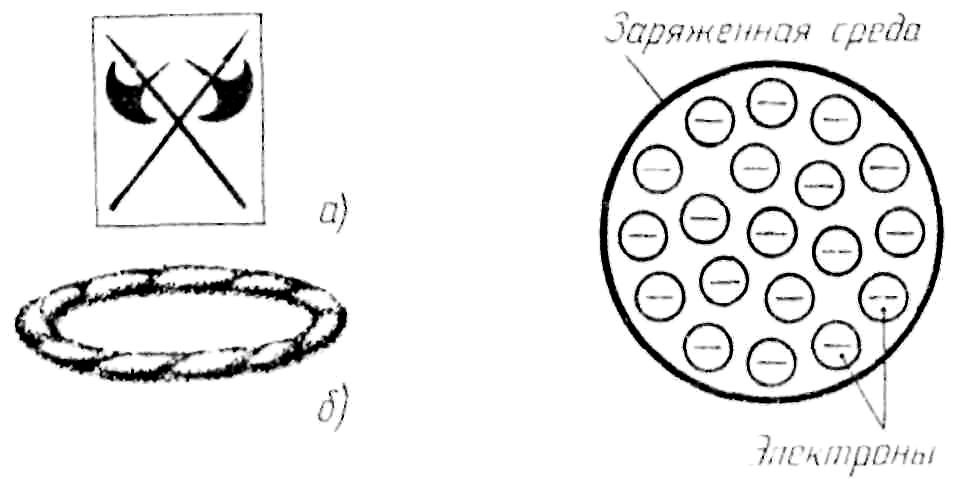 ариж,
1626 г.: учение об атоме запрещено под
страхом смерти.
ариж,
1626 г.: учение об атоме запрещено под
страхом смерти.
К
Кельвин предложил
модель: вихревой атом в виде
микроскопического колечка дыма (1902)
Ядерная модель атома
Э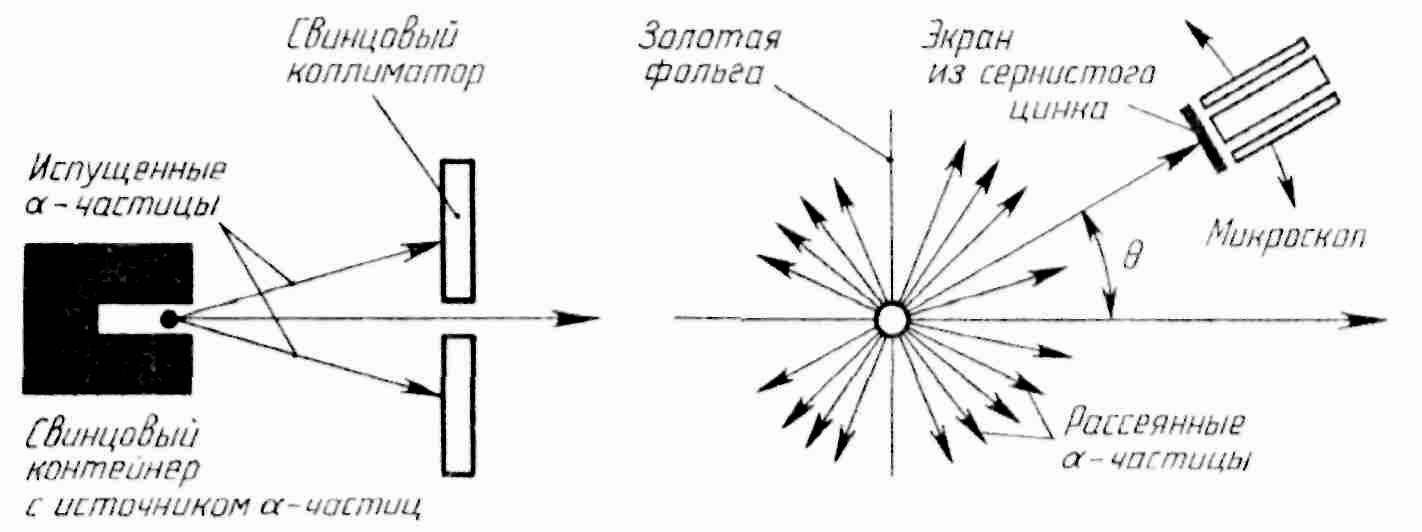 кспериментальная
проверка модели Томсона была осуществлена
в 1911 г. английским физиком Э. Резерфордом.
Пропуская пучокα-частиц
(заряд +2е,
масса 6,64∙10−27
кг) через тонкую золотую фольгу,
Э.Резерфорд обнаружил, что какая-то
часть частиц отклоняется на довольно
значительный угол от своего первоначального
направления, а небольшая часть α-частиц
отражается от фольги. Но согласно модели
атома Томсона эти α-частицы
при взаимодействии с атомами фольги
отклоняются на малые углы, порядка 2°.
кспериментальная
проверка модели Томсона была осуществлена
в 1911 г. английским физиком Э. Резерфордом.
Пропуская пучокα-частиц
(заряд +2е,
масса 6,64∙10−27
кг) через тонкую золотую фольгу,
Э.Резерфорд обнаружил, что какая-то
часть частиц отклоняется на довольно
значительный угол от своего первоначального
направления, а небольшая часть α-частиц
отражается от фольги. Но согласно модели
атома Томсона эти α-частицы
при взаимодействии с атомами фольги
отклоняются на малые углы, порядка 2°.
Р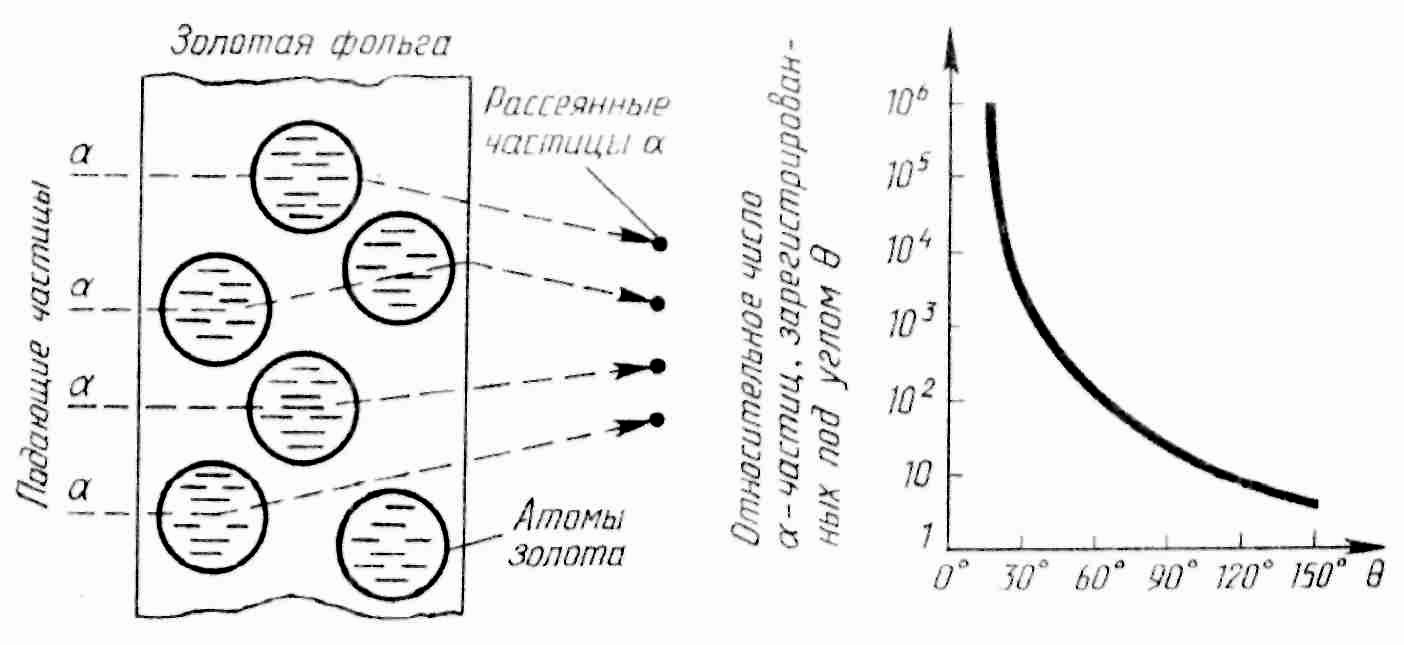 езерфорд
показал, что модель Томсона находится
в противоречии с его опытами. Обобщая
результаты своих опытов, Резерфорд
предложил ядерную (планетарную) мидель
строения атома:
езерфорд
показал, что модель Томсона находится
в противоречии с его опытами. Обобщая
результаты своих опытов, Резерфорд
предложил ядерную (планетарную) мидель
строения атома:
1. Атом имеет ядро, размеры которого малы по сравнению с размерами самого атома.
2. В ядре сконцентрирована почти вся масса атома.
3. Отрицательный заряд всех электронов распределен по всему объему атома.
Расчеты показали,
α-частицы,
которые взаимодействуют с электронами
в веществе, почти не отклоняются. Только
некоторые α-частицы
проходят вблизи ядра и испытывают резкие
отклонения. Если
![]() или потенциальная энергия системыα-частица
– ядро
или потенциальная энергия системыα-частица
– ядро
![]() и
и![]() ,
тоα-частица
будет отброшена назад. При расчете
учитывают, что qα
= 2e,
где е
– заряд электрона; qя
= Ze,
где Z
– зарядовое число, равное количеству
электронов в атоме; диаметр ядра 10−14
– 10−15
м, атома 10−10
м.
,
тоα-частица
будет отброшена назад. При расчете
учитывают, что qα
= 2e,
где е
– заряд электрона; qя
= Ze,
где Z
– зарядовое число, равное количеству
электронов в атоме; диаметр ядра 10−14
– 10−15
м, атома 10−10
м.
О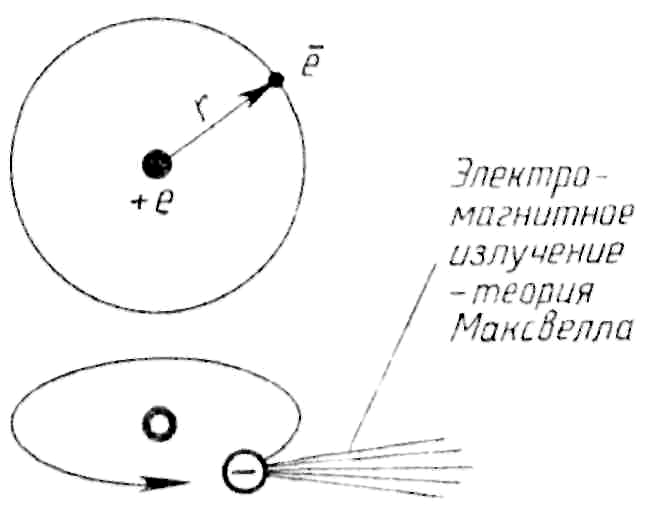 днако
предложенная модель строения атома не
позволила объяснить устойчивость атома.
днако
предложенная модель строения атома не
позволила объяснить устойчивость атома.
Ускоренное движение электрона согласно теории Максвелла сопровождается электромагнитным излучением, поэтому энергия электрона уменьшается, и он движется по спирали, приближаясь к ядру. Казалось бы, электрон должен упасть на ядро, так как при движении по спирали уменьшается энергия электрона, в действительности атомы являются устойчивыми системами.
Постулаты Бора
В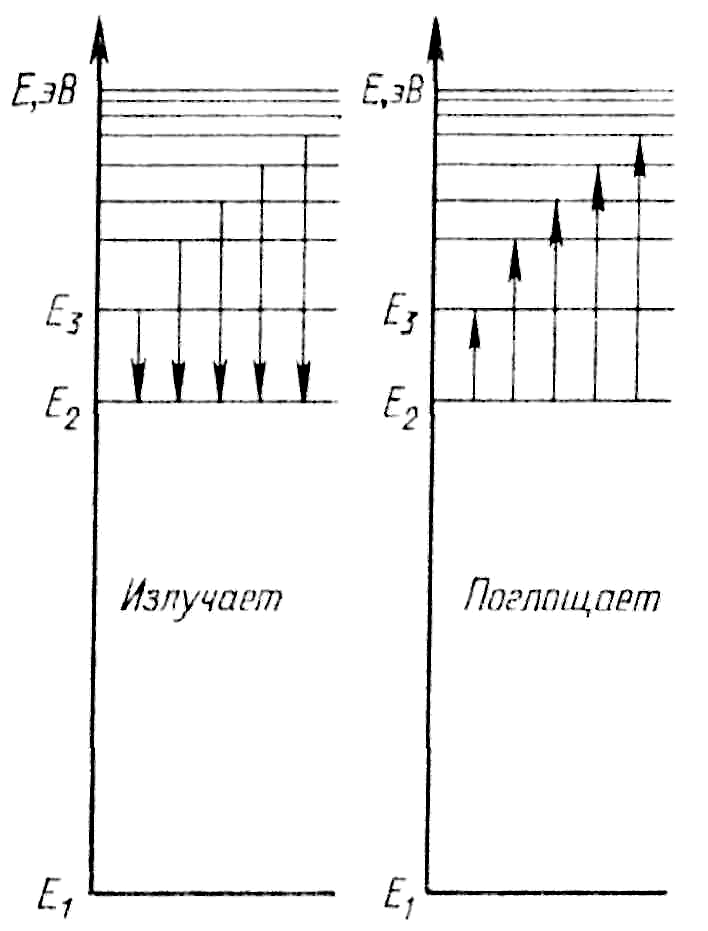 ыход
из этого затруднительного положения
был предложен Н.Бором. В основе его
теории лежат следующие постулаты:
ыход
из этого затруднительного положения
был предложен Н.Бором. В основе его
теории лежат следующие постулаты:
1. Атомная система может находиться только в особых стационарных квантовых состояниях, каждому из которых соответствует определенная энергия Еn. В стационарном состоянии атом не излучает.
2. При переходе атома из стационарного состояния с большей энергией Ek в стационарное состояние с меньшей энергией Еn излучается квант энергии:
hνkn
= Ek
− En,
![]()
3. В стационарном
состоянии атома электрон, двигаясь по
круговой орбите, должен иметь дискретные,
квантованные значения момента импульса
mvnrn
= nh,
где n
= 1, 2, 3 … - номер орбиты; r
– радиус орбиты (![]() ):
):
![]()
Постулаты Бора объясняют происхождение линейчатых спектров и их закономерности. Выражение для радиусов разрешенных орбит:
![]() ,
где me
и e – масса и заряд.
,
где me
и e – масса и заряд.
ОК-31
