
- •Абдуразова перизат адилбековна Әртүрлі материалдарға мыс және оның аналогтары құрамды қабықшаларды фотохимиялық тұндырудың технологиясын әзірлеу және олардың бактерицидті қасиеттерін зерттеу
- •6D072000 - Бейорганикалық заттардың химиялық технологиясы
- •Мазмұны
- •Нормативтік сілтемелер
- •Анықтамалар
- •1.1 Мыс және оның аналогтары құрамды қабықшалар туралы түсініктеме
- •1.2 Диэлектрлі беттерде металл қабықшасын алу жолдары
- •1.3 Химиялық және фотохимиялық ыдырату арқылы металдандыру
- •1.4 Мыс және оның аналогтарының бактерицидті қасиеті мен қолдану аймағы
- •2 Зерттеу нысандары мен әдістері
- •2.1 Зерттеу нысаны
- •2.2 Зерттеу әдістері
- •2.3 Қаптамалардың қалыңдығын, құрамын және бактерицидтік қасиеттерін анықтау әдістемесі
- •3 Диэлектрлі беттерді фотохимиялық металдандыру үрдісінің механизмі
- •3.1 Фотохимиялық әдіс үрдісінде жүретін реакциялар механизмі
- •3.2 Металл түзілу үрдісі және кинетикалық заңдылықтарын анықтау
- •4 Фотохимиялық тотықсыздандыру арқылы металл қабықшаларын алу технологиясын жасау
- •4.1 Диэлектрлі беттерге мыс қабықшаларын фотохимиялық әдіспен қондыру және зерттеу
- •4.2 Алтын қабықшаларын фотохимиялық әдіспен диэлектрлі беттерге қондыру және зерттеу
- •4.3 Күміс қабықшаларын фотохимиялық әдіспен диэлектрлі беттерге қондыру және зерттеу
- •4.4 Газфазалы тотықсыздандырғыш қатысында аралас қабықшаларды фотохимиялық әдіспен диэлектриктердің бетіне қондыру және зерттеу
- •4.5 Мыс және оның аналогтары қаптамасын алудың технологиялық сызбасы
- •5 Мыс және оның аналогтары құрамды қабықшаларымен қапталған материалдардың бактерицидті қаситтерін зерттеу
- •5.1 Мыс, алтын және күміспен қапталған үлгінің бактерицидті қасиетін зерттеу
- •5.2 Қалыпты жағдайдағы микроорганизмдерге мыс және оның аналогтарықұрамды қабықшаларды зерттеу
- •Тұжырым
- •Пайдаланылған әдебиеттер тізімі
- •Цупак т.Е. Лабораторный практикум по технологии электрохимических покрытий. - м.: Химия, 1980. - 160 с.
- •Карякин ю.В., Ангелов и.И. Чистые химические вещества. - Изд. 4-е, перераб. И доп. - м.: Химия, 1974. - 408 с.
- •Рид с.Дж.Б. Электронно-зондовый микроанализ и растровая электронная микроскопия в геологии. - м.: Изд-во «Техносфера», 2008. – 232 с.
- •Goldstein j.I. Scanning electron microscopy and X-ray microanalysis // Наименование журнала. - Springer, 2003. – Vol. ???. – p. ??-??
1.1 Мыс және оның аналогтары құрамды қабықшалар туралы түсініктеме
Мыс
және оның галогенидтерінің химиялық
қасиеттері. Мыс,
Cu
– элементтердің периодтық жүйесінің
І-тобындағы химиялық элемент, атомдық
нөмірі 29, атомдық массасы 63,546. Табиғатта
тұрақты екі изотопы бар: 63Cu
және 65Cu.
Жер қыртысындағы массасы бойынша мөлшері
4,7
 10-3%.
Негізгі минералдары: халькопирит,
халькозин,ковелин,
малахит,
азурит.
Пластикалық қызыл түсті металл, кристалл
торы қырлары центрленген кубтық,
тығыздығы 8,94 г/см3,
балқу температурасы 1084,5°С, қайнау
температурасы 2540°С, тотығу дәрежесі
+1, +2. Құрғақ ауадағы бөлме температурасында
тотықпайды. Қыздырғанда ауада CuО және
Cu2О-ға
дейін тотығады, галогендермен, S, Se, HNO3,
H2SO4-пен
әрекеттеседі. Аммиак,
цианидтермен, т.б. кешенді қосылыстар
түзеді. Сульфид концентратын балқытып,
одан түзілген мыс штейнін қара мысқа
дейін тотықтырып, оны жалынмен не
электролиттік әдіспен тазарту арқылы;
гидрометаллургиялық әдіс – құрамында
мысы бар минералдарды күкірт қышқылымен
(немесе NH3
ерітіндісімен) өңдеп, одан әрі электролиздеу
арқылы алады.
Мыс кабельдердің, электр қондырғылары
мен жылу алмастырғыштардың ток өткізгіш
бөлігін жасау үшін пайдаланылады;
қорытпалардың (латунь,
қола,
мыс-никель,
т.б.) құраушысы ретінде қолданылады [2].
10-3%.
Негізгі минералдары: халькопирит,
халькозин,ковелин,
малахит,
азурит.
Пластикалық қызыл түсті металл, кристалл
торы қырлары центрленген кубтық,
тығыздығы 8,94 г/см3,
балқу температурасы 1084,5°С, қайнау
температурасы 2540°С, тотығу дәрежесі
+1, +2. Құрғақ ауадағы бөлме температурасында
тотықпайды. Қыздырғанда ауада CuО және
Cu2О-ға
дейін тотығады, галогендермен, S, Se, HNO3,
H2SO4-пен
әрекеттеседі. Аммиак,
цианидтермен, т.б. кешенді қосылыстар
түзеді. Сульфид концентратын балқытып,
одан түзілген мыс штейнін қара мысқа
дейін тотықтырып, оны жалынмен не
электролиттік әдіспен тазарту арқылы;
гидрометаллургиялық әдіс – құрамында
мысы бар минералдарды күкірт қышқылымен
(немесе NH3
ерітіндісімен) өңдеп, одан әрі электролиздеу
арқылы алады.
Мыс кабельдердің, электр қондырғылары
мен жылу алмастырғыштардың ток өткізгіш
бөлігін жасау үшін пайдаланылады;
қорытпалардың (латунь,
қола,
мыс-никель,
т.б.) құраушысы ретінде қолданылады [2].
Мыс (І) хлориді - суда ерімейтін ақ түсті кристалды зат. Ол тұз қышқылында және аммиактың сулы ерітіндісінде түссіз кешенді ерітінді түзіп ериді. Мыстың басқа бір валентті қосылыстары сияқты ол да тұрақсыз. Ылғалды күйінде ауада тотығады, гидролиздену және диспропорциялану үрдісіне бейім. Әсіресе тотықсыздандырғыштың қатысында жарықтың әсерінен ыдырайды. Сондықтан оны таза күйінде алу өте қиын, әдетте алынған өнім әртүрлі жасыл түс береді, ақ түсті өнім алу үшін синтездеу кезінде оны тотығудан сақтау керек. Оны қараңғы салқын жерде сақтау керек, әсіресе ауа кірмейтін және ылғалдан.
Мыс (І) хлоридін екі әдіспен алуға болдаы [3]: Мыс (ІІ) қосылыстарын тотықсыздандыру немесе мыс (І) оксидін тұз қышқылында еріту арқылы. Мыс (ІІ) қосылыстарын әртүрлі тотықсыздандырғыштармен тотықтыруға болады. Мыс (І) оксидін тұз қышқылында еріту аса ыңғайлы әдіс:
Cu2O + 2HCl -> 2CuCl + H2O. (1.1)
Cu2O + 4HCl -> 2H[CuCl2] + H2O. (1.2)
Екінші реакция тұз қышқылының артық мөлшерінде жүреді, себебі мыс хлориді тұнба түспей тұрақсыз түссіз хлорлы комплекс түзеді, ол сұйытылған ерітіндіде ыдырайды:
H[CuCl2] -> CuCl + HCl. (1.3)
Мұнда мыс (І) хлориді тұнбаға түседі. Осы реакцияның нәтижесінде ерітіндіні сүзгілеу арқылы мыс хлоридін механикалық қоспадан тазартуға болады.
Өнеркәсіпте мыс (І) хлоридін бірнеше әдіспен алады [4]:
1 CuCl балқымасының үсітінде ілініп тұрған мыстың артық мөлшерін хлорлау:
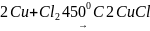 . (1.4)
. (1.4)
2 Қышқылдандырылған ерітіндіде мыспен CuCl2 тотықсыздандыру:
 .
(1.5)
.
(1.5)
Сондай-ақ зертханалық жағдайда ең көп тарағаны соңғы әдіс.
1
Өте таза препаратты мыс пен газ тәрізді
хлор сутекті әрекеттестіру арқылы алуға
болады:
 . (1.6)
. (1.6)
2 Осыған ұқсас реакция ерітіндіде тотықтырғыштардың қатысында жүреді (O2, HNO3, KClO3):
 .
(1.7)
.
(1.7)
3 Мысты (ІІ) күкірт қостотығымен тотықсыздандыру ыңғайлы әдіс:
 .
(1.8)
.
(1.8)
4 Хлоридтің артық мөлшерін сульфитпен тотықсыздандыру:
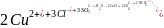 .
(1.9)
.
(1.9)
5 Кері диспропорциялану реакция арқылы:
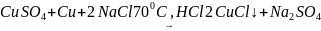 (1.10)
(1.10)
6 Дихлоридті термиялық ыдырату арқылы мыстың монохлоридін алу:
 .
(1.11)
.
(1.11)
Мыс (І) галогенидтерін зертханалық жағдайларда келесі реакциялар бойынша алады [4, б. 218]:
2CuSO4∙5H2O+2NaCl+SO2+H2O=2CuCl+Na2SO4+2H2SO4+10H2O . (1.12)
2CuSO4∙5H2O+2KBr+SO2+2H2O=2CuBr+2H2SO4+K2SO4+10H2O. (1.13)
2CuSO4∙5H2O+2KI+SO2+2H2O=2CuCl+2H2SO4+K2SO4+10H2O. (1.14)
Мыс (ІІ) галогенидтерін мынадай реакция бойынша алады:
Cu(CH3COOH)2+2CH3COCl = CuCl2+2(CH3CO)2O. (1.15)
CuO+2HBr=CuBr2+H2O. (1.16)
Химиялық қасиеттері:
1 Мыстың монохлорид суспензиясын қыздырған кезде диспропорциялану реакциясы жүреді [5]:
 .
(1.17)
.
(1.17)
2 Мыс монохлориді тұз қышқылында еріп қайтымды кешенді қосылыс түзеді:
 .
(1.18)
.
(1.18)
3 Мыс монохлориді құрғақ ауада тұрақты, бірақ ылғалда хлорид негіздеріне дейін тотығады (кристалдарға жасыл түс береді):
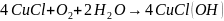 .
(1.19)
.
(1.19)
4 Қышқылды ортада тотығып орта тұз түзеді:
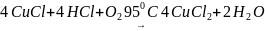 .
(1.20)
.
(1.20)
5 Азот қышқылының ыстық концентрациясында да тотығу реакциясы жүреді:
 .
(1.21)
.
(1.21)
6 Мыс монохлоридінің аммиакты ерітіндісі ацетиленді жұтып қызыл тұнба түзеді:
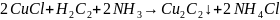 .
(1.22)
.
(1.22)
7 Мыс монохлоридінің қышқыл ерітіндісі көміртек тотығын жұтып қайтымды реакция түзеді:
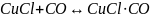 .
(1.23)
.
(1.23)
Күміс және оның галогенидтерінің химиялық қасиеттері. Күміс - созылымды, иілгіш металл болып табылады, күмістің меншікті салмағы 10,5 г/см3; атомдық салмағы 107,88; валенттілігі 1; сутекті электродқа қарағандағы стандартты потенциалы +0,81 В; электрохимиялық эквиваленті 4,025 г/а-с; балқу температурасы 9600С. Меншікті электрөткізгіштігі 62∙104 ом-1см-1 тең. Күміс - жалтырауық, жұмсақ, жақсы созылғыш, жылуды және электр тогын жақсы өткізетін, ақ түсті металл. Сол жұмсақтығынан өзі жеке көп пайдаланылмайды. Оның құймасын түрлі бұйымдарды қасық, пышақ, түрлі ыдыстар, әшекей заттарды т.б. жасауға қолданады. Күмістің мұндай бұйымдар жасау үшін жиі қолданылатын құймасында 87,5% күміс, 12,5% мыс болады. Күміс заттарда сынама (үлгі) дейтін болады. Ол 1000 г құймадағы күмістің мөлшерін көрсететін сан. Мысалы, 8751-іңші сынаманың әрбір 1000 г 875 г күміс болады. Алынатын күмістің көпшілігі басқа металдардың бетіне жалатуға, бір бөлімі күміс-мырыш аккумуляторларын жасауға жұмсалады. Күміс жоғары электрөткізгіштігімен, жоғары шағылдырғыштық қасиетімен және көптеген агрессивті ортада мысалы, сілтілер мен көптеген органикалық қышқылдарда айтарлықтай жоғары химиялық тұрақтылығымен ерекшеленеді; концентрлі күкірт қышқылы күмісті тек қайнатқан жағдайда, ал концентрлі азот қышқылы қыздырған жағдайда ғана ерітеді. Күміс хлормен, күкіртті қосылыстармен қарая отырып әрекеттеседі. Өзінің физика-химиялық байланысты күміс сирек кездесетіндігіне және қымбаттылығына қарамастан, гальваникалық қаптамалар үшін көптеп қолданылады. Осы қаптамалар келесідегідей жағдайларда қолданылады: жарықтехникалық және оптикалық бұйымдардың шағылдырғыштық қасиетін жоғарлатады; электротехникалық бұйымдардың ұласқан жерлеріндегі ауыспалы кедергілерін максималды төмендету; сілтілі және басқа да ортада жұмыс істейтін бұйымдардың коррозиялық беріктілігін арттыру. Күміс табиғатта сап күйде және қосылыстар құрамында кездеседі. Қосылыстарының маңыздысы күміс жылтыры - аргентит Ag2S (мыс және қорғасын кендерінде кездеседі) [6].
Күміс кендері Оралда, Қазақстанда, Алтайда, Кавказда және т.б. жерлерде бар. Кен ішіндегі мыс пен қорғасынды алғанда күміс бірге шығады.
Қорғасын мен күмістің қоспасын балқыған күйден қатырғанда қорғасын кристалдары бет жағына шығады. Астыңғы жағындағы күмісті қорғасыннан бөлу үшін ауа үрлейді, онда қорғасын тотығады да, күміс таза қалады.
Күміс актив емес металл (активтік қатарының соңында), ауада да, оттекте де тотықпайды. Күміс озонмен әрекеттесіп, қара түсті күміс (ІІ) оксиді түзіледі:
Аg+Оз=АgО+О2. (1.24)
Күміс қышқылдардан азот қышқылында ғана ериді. Онда күміс нитраты АgNОз түзіледі:
АgО+2НNОз=АgNОз+NО2+Н20. (1.25)
Концентрленген ыстық күкірт қышқылында да ериді.
Күміс тұзының ерітіндісіне сілтімен әрекеттесе, күмістің гидроксиді AgOH түзіледі, бірақ берік қосылыс болмағандықтан айырылып Ag20 айналады:
2АgNОз+2NаОН=2NаNОз+Аg2О+Н2О. (1.26)
иондық түрде:
2Ag +20Н' = Ag2O + Н2О. (1.27)
Ag2O, 2000°С жоғары кыздырса, молекуласы өздігінен тотығу-тотықсыздану процесіне ұшырайды:
2Ag20=4Ag+02. (1.28)
Ag20 сумен реакциясы кайтымды:
Ag20 + H20+±2AgOH. (1.29)
Күміс қосылыстарының көпшілігінде тізбекті кристалл түзеді, мысалы:
-Ag-C=N-Ag-C=N-Ag-C=N-. (1.30)
Күміс бір валентті мыс сияқты аквокомплекс бермегенімен, амминокомплекс түзеді
Аg2О+4NНз+Н2О=2 [Аg(NНЗ)2] (ОН). (1.31)
Галогенидтері суда ерімейді, бірақ күміс иодиді калий иодидінде, күміс бромиді тиосульфат ерітінділерінде комплекстер түзе ериді: .
AgI + ІО = К [AgI2] АgВr+2Nа2S2O3=Nа3[Аg(S2OЗ)2] +NaBr. (1.32)
Соңғы реакция фотографияда кеңінен қолданылады.
Күміс тұздарының маңыздылары - күміс нитраты.
АgNО3, оны ляпис деп те атайды. Түссіз мөлдір кристалдар, суда жақсы ериді. Бұл тұз айна жасауда, гальванопластикада, фото жұмысында және медицинада кішкене жаралардың аузын күйдіріп бүрістіруге қолданады.
Күміс бромиді AgBr - фото пластинкалардың, пленкалардың және фото қағаздың бетіндегі жарық сезгіш қабатының құрамына кіреді. Жарық әсерінен бұл тұз айырылып кұрамындағы күміс өте ұсақ түрде қара түсті болып бөлініп шығады. Күміс те комплекс түзгіш зат. азот күміс тұзының ерітіндісіне калий цианидын артығырақ етіп қосса, комплексті тұз K[Ag(CN)2] түзіледі [7]:
АgNОз+ KCN =tAgCN + КNОз. (1.33)
AgCN+KCN=K[Ag(CN)2]. (1.34)
Күмістің AgCl, Ag20 сияқты суда ерімейтін қосылыстары аммиакта жақсы ериді. Оның себебі, куміс катионы аммиак молекулаларын айналасына координациялап, комплекс ионын түзеді:
AgCI +2NНз= [Аg(NНЗ)2] СІ. (1.35)
Алтын және оның галогенидтерінің химиялық қасиеттері. Алтын- асыл металл, мыс пен күміске қарағанда ауыр, қиын балқиды және жұмсақ. Молекулалық массасы = 196,967; Тығыздығы (г/см3)= 19,29; Тбалқу = 1064,43 °С; Тқайнау = 2947°С. Алтын өзінің химиялық қосылыстарында +1 және +3 тотығу дәрежесін көрсетеді. Алтынның барлық қосылыстары тұрақсыз және оңай металға дейін тотықсызданады, тіпті қыздырғанда да.
Бұл металдың қасиетін оның төмен химиялық активтілігі көрсетеді. Ауада, тіпті ылғалда алтын өзінің қасиетін өзгертпейді. Тіпті жоғары температурада да алтын сутекпен, оттекпен, азотпен, күкіртпен және көміртекпен де әрекеттеспейді.
Алтын галогендермен қосылыс түзеді, броммен бөлме температурасында, ал фтор, хлор және иодпен қыздырғанда реакцияға түсу үрдісі жүреді.
Алтынның электродтық потенциалы сулы ерітіндіде өте жоғары:
Au => Au+ + е, E0= + 1,88В;
Au=>Au3+ +3е, E0 = + 1,58В.
Сондықтан алтын ешқандай сілтіде де, қышқылда да, тіпті, күкірт, азот, тұз, балқытқыш, органикалық қышқылдарда да ерімейді.
Алайда, күшті тотықтырғыштардың қатысында алтын бірқатар минералды қышқылдарда ериді. Ол иод қышқылы H5IO6, марганец қостотығы, азот қышқылының қатысуымен концентрленген күкірт қышқылында ериді, сондай-ақ сусыз ыстық селен қышқылында да H2Se04, бұлар өте күшті тотықтырғыштар болып табылады.
Алтын патша арағында, оттегі қатысындағы сілтілік және сілтілік жер металдарының цианидті сулы ерітінділерінде, хлормен қаныққан түз қышқылында оңай ериді.
Темір (ІІІ) сульфаты немесе хлорид тотықтырғышы бар, тиомочевинаның сулы ерітіндісі алтынның жақсы еріткіші болып табылады [8].
Алтынның әрекеттесу реакциялары (1.36-1.48):
1 Au + HNО3(конц.) + 4HCl (конц.) = H[AuCl4] + NO + 2H2O.
2 2Au + 6H2SeO4= Au2(SeO4)3 + 3SeO2 + 6H2O (200°C).
3 2Au+ 3F2 = 2AuF3 (300 – 400°C).
4 2Au + 3Cl2 = 2AuCl3 (150°C дейін).
5 2Au + Cl2 = 2AuCl (150 – 250°C).
6 2Au + 2Br2 (с) = АuBr3 + AuBr (20–35°C).
7 2Au + I2 = 2AuI (120 – 393°C).
8 2Au + 3Cl2 + 2H2O = 2H[AuCl3(OH)].
9 Au + 3E2 + 2HЕ (конц.) = 2H[AuE4] (E= Cl, Br, I).
10 4Au + 8MCN (конц.)+ O2 + 2H2O = 4M[Au(CN)2] +4MOH (M=Na, K).
11 Au + K[Ag(CN)2] = K[Au(CN)2] + Ag.
12 Au + NaNO3 = NaAuO2 + NO (350–400°C).
13 2Au + 5KrF2 = 2AuF5 + 5Kr.
Алтынның галогенидтері. Алтын хлориді (I) ашық жасыл түсті, термиялық тұрақсыз, ыдырап балқиды. Салқын суда ерімейді, кристаллогидраттар түзбейді. Ыстық суда ыдырайды, қышқылдармен, сілтілермен, аммиак гидратымен әрекеттеседі. Кешендітүзу реакциясына түседі [9].
Алтын (І) хлоридін, Аu (III) хлоридін 180-190°С дейін абайлап қызыдырып алуға болады:
АuСl3 = AuCl + Cl2. (1.49)
ал, 200°С-тан жоғары температурда элементке дейін ыдырайды және бұлынғыр-сары түсті ұнтақ болып табылады. Алтын (І) хлориді тіпті бөлме температурасында да Аu(III) хлориді мен металдық Аu дейін баяу диспропорцияланады:
3AuCl = 2Au + AuCl3. (1.50)
Алтын хлоридінің (I) әрекеттесу реакциялары (1.51-1.55).
1 2AuCl = 2Au+ Сl2 (жоғары 289°С).
2 3AuCl + H2O (ыстық) = H[AuCl3(OH)] + 2Au
3 AuCl + МСl(конц.) = M[AuCl2] (M = Н, Na, K)
4 2AuCl + 3NaOH (конц., ыстық.) = Na[Au(OH2)] + AuOH (золь) + NaCl
5 AuCl + 2(NH3 ·Н2O)[конц] = [Au(NH3)2]Cl + 2Н2O
Алтын (І) бромиді өзінің қасиеті бойынша AuCl ұқсас. Алтын (І) бромидін AuBr3 200°С-тан жоғары температурада қыздырып алуға болады, бірақ 250 °С-тан жоғары температурада бірден элементке дейін ыдырайды. Ылғалдың әсерінен AuBr, AuCl сияқты AuBr3 мен металдық Аu дейін диспропорцияланады. Сілтілі металдардың бромидті ерітіндісінде AuBr еріп кешенді анион [AuBr2] - түзеді.
Алтын (І) иодидін бөлме температурасында AuI3 ыдырату арқылы алады. Қыздырғанда AuI, AuCl және AuBr қарағанда оңай ыдырайды. Керісінше, басқа галогенидтерге қарағанда алтын (І) иодиді сумен баяу әркеттеседі. Иодид ионы қатысында AuI еріп, [Aul2] - кешенді ионын түзеді.
Иод ерітіндісінің HI немесе KI сулы ерітіндісі әсерінен кешенді AuI2- анионы түзіліп, ұсақдисперсті алтын соңынан ериді.
2Au + I2 + 2I- = 2AuI2-. (1.56)
Алтын (І) иодиді ерітіндісін алтынқұрамды қалдықтарды өңдегенде қолданады.
Алтын хлориді (III). Алтынның хлоридін ~240°С температурада алтын ұнтағының үстінен газ түріндегі хлорды өткізу арқылы алады. Түзілген хлорид айдалады және тұндырғанда қызыл түске боялады. AuС13 суда ериді, бұл қоспаның сулы ерітіндісінің түсі қызыл-қоңыр түсті, бұл кешенді қосылыстың түзілуімен түсіндіріледі:
AuCl3 + Н2O= Н2[AuОС13]. (1.57)
Алтын хлоридінің (III) әрекеттесу реакциялары. Алтын хлориді (III) жабық қызыл түсті, ұшқыш (AuСl3), қыздырғанда ыдырайды, хлордың артық қысымында балқиды. Сондай-ақ алтын (III) хлориді жарықтың әсерінен біртіндеп ыдырайды. 100оС-тан жоғары температурада алтын (III) хлориді хлор мен хлорлы алтынға дейін, ал 220оС-тан жоғары температурада хлор мен металдық алтынға ыдырайды. Сумен өңдегенде құрамын өзгертіп ерітіндіге өтеді. Қышқылдармен, сілтілермен әрекеттеседі. Сулы ерітіндідегі реакциясында Н[АuСl4] түрінде болады (1.58-1.66).
AuCl3 = AuCI + Cl2 (150 - 185°С).
AuCI3·2H2O =AuCl3 + 2H2O (30°С жоғары)
AuCl3 + 2H2O= [АuСl3(ОН)]- + Н3O+.
AuCl3 + HCl (конц.) = H[AuCl4].
2AuCl3 + 6NaOH (сұйылтылған) = Au2O3 + 6NaCl + 3H2O.
2AuCI3 + 3F2 = 2AuF3 + 3C12 (200°С).
2AuCl3 + 3H2S = Au2S3 + 6HCI (эфирде).
2AuCl3 + 3H2O2 (конц.) = 2Au (коллоид) + 3O2 + 6HC1.
AuCl3 + 3FeS04 = А11 + Fe2(S04)3 + FeCl3 (200°С).
AuCl3 + 4Na2S03S (конц.) = Na3[Au(S03S)2] + 3NaCl + Na2S4O6.
Басқа Au(Ш) галогендерінің ішінен AuI3 қызықты болып табылады. Оның қосылыстары суда ерімейді, ұнтағы жабық-жасыл түсті. Алтын (ІІІ) иодидін төртхлорлыалтын қышқылды ерітіндісін калий иодиді ерітіндісіне қосу арқылы бейтараптап алады:
AuСl4- + 3I- = AuI3 + 4Сl-. (1.67)
