
Теплоемкость калориметрической системы можно записать по приближенной формуле:
Cобщ=Cстакана +Cтермометра +Cмешалки + Сраствора.
Теплоемкостью термометра необходимо пренебречь, а теплоемкости остальных частей определить по формуле:
C
= Cудm,
где m
– масса вещества, г , а Cуд-
удельная теплоемкость вещества,

При дальнейших расчетах возникают трудности, связанные с тем, что удельная теплоемкость в значительной мере зависит от состава. Теплоемкость дистиллированной воды составляет 4187 Дж/г∙К, но водные растворы неорганических соединений имеют теплоемкость от 2,9 до 3,9 Дж/г∙К. К тому же их теплоемкость зависит от их концентрации и температуры. Аналогично, учитывая, что стекло и сталь (мешалка), могут иметь различную теплоемкость в зависимости от состава (сорта), ниже при расчетах приведены усредненные значения Cуд.
Сстакана
= С уд.стеклаm1
; ( )
)
Cраствора
= C уд.
раствораmр-ра
; ( )
)
Cмешалки
= C уд.
сталиmмеш.;
( ).
).
Изменение
температуры в ходе реакции определить
графически в соответствии с рис.3 на
миллиметровой бумаге. На оси абсцисс
отложить время в масштабе 1 мин = 1 см, на
оси ординат- температуру, выбор масштаба
которой зависит от величины
 .
При
.
При
 при
при После
того, как на график нанесены все
экспериментальные точки, получается
кривая ABCD.
Участок АВ называется предварительным
периодом, ВС- главным, СD-
заключительным. Чтобы определить
измерение температуры
,
не искаженное
теплообменом, происходящим в течение
главного периода, продолжить АВ и СD
до пересечения с вертикальной прямой
EF.
Для этого точки mи
n,
соответствующие начальной и конечной
температуре главного периода, нанести
на ось ординат. Через середину отрезка
mn
провести линию КР. Пересечение этой
линии с кривой ВС дает точку L, определяющую
положение прямой EF.
Отрезок EFи
будет равен
После
того, как на график нанесены все
экспериментальные точки, получается
кривая ABCD.
Участок АВ называется предварительным
периодом, ВС- главным, СD-
заключительным. Чтобы определить
измерение температуры
,
не искаженное
теплообменом, происходящим в течение
главного периода, продолжить АВ и СD
до пересечения с вертикальной прямой
EF.
Для этого точки mи
n,
соответствующие начальной и конечной
температуре главного периода, нанести
на ось ординат. Через середину отрезка
mn
провести линию КР. Пересечение этой
линии с кривой ВС дает точку L, определяющую
положение прямой EF.
Отрезок EFи
будет равен
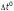 ,
отрезок mn=
,
отрезок mn= .
Чем меньше температурный ход в
предварительном и заключительном
периоде, тем меньше потери теплоты за
счет теплообмена и тем ближе
и
.
.
Чем меньше температурный ход в
предварительном и заключительном
периоде, тем меньше потери теплоты за
счет теплообмена и тем ближе
и
.

Рис. 3
Определить число молей кислоты в растворах

где mк-ты
- масса раствора кислоты, -
эквивалентная концентрация кислоты (1
моль-экв/л или 2 моль-экв/л),
-
эквивалентная концентрация кислоты (1
моль-экв/л или 2 моль-экв/л), -
плотность раствора кислоты(1,01 или 1,02
-
плотность раствора кислоты(1,01 или 1,02
 ).
).
Расчет погрешности эксперимента.

где
 -
экспериментально определенное значение
энтальпии реакции;
-
экспериментально определенное значение
энтальпии реакции;
 -
теоретическое значение энтальпии
реакции нейтрализации сильной кислоты
сильным основанием. Нейтрализация моля
эквивалентов любой сильной кислоты
любым сильным основанием в разбавленных
растворах всегда сопровождается одним
и тем же экзотермическим эффектом,
равным 55,8 кДж/моль. Этот факт теория
электролитической диссоциации объясняет
тем, что реакция нейтрализации сводится
к образованию молекул воды:
-
теоретическое значение энтальпии
реакции нейтрализации сильной кислоты
сильным основанием. Нейтрализация моля
эквивалентов любой сильной кислоты
любым сильным основанием в разбавленных
растворах всегда сопровождается одним
и тем же экзотермическим эффектом,
равным 55,8 кДж/моль. Этот факт теория
электролитической диссоциации объясняет
тем, что реакция нейтрализации сводится
к образованию молекул воды:
[H++ Cl-]+[Na++OH-]=[ Na++ Cl-]+H2O, т.е. H++OH-=H2O.
Для
участников реакции H++OH-=H2O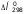 соответственно равны 0, -230,02 и -285,83
кДж/моль. По закону Гесса
для реакции нейтрализации:
-285,83+230,02=-55,8 кДж/моль.
соответственно равны 0, -230,02 и -285,83
кДж/моль. По закону Гесса
для реакции нейтрализации:
-285,83+230,02=-55,8 кДж/моль.
Главным
фактором, определяющим точность
результата, будет погрешность определения
 (заведомое
пренебрежение теплоемкостью термометра,
изменяющейся теплоемкостью раствора
в результате реакции и др.), т.к. ошибки
взвешивания не превышают сотых долей
процента.
(заведомое
пренебрежение теплоемкостью термометра,
изменяющейся теплоемкостью раствора
в результате реакции и др.), т.к. ошибки
взвешивания не превышают сотых долей
процента.
