
Неорганічна хімія
.doc2. Біогенні елементи.
Ступінь окиснення – це такий умовний заряд, який був би на атомі, якщо всі зв’язки були йонними.
Дисоціація – це процес розпаду молекул на Йони. Катіони +, аніони -.
Властивість електролітів – ступінь дисоціації α відношення кількості молекул, що розпадуться на йони до загальної кількості молекул.
α>30% - сильні електроліти.
α<3% - слабкі електроліти.
30%>α>3% - електроліти середньої сили.
Сильні електроліти:
-
Кислоти – HCl, HBr, HI, H2SO4, HNO3, HMnO4, HClO4, HClO3.
-
Основи – LiOH, NaOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2.
-
Солі – практично всі водорозчинні.
Реакція нейтралізації – це реакція взаємодії кислоти з основою з утворенням солі і води.
Дисоціація води:
H2O↔H+ + OH-
[H+] = [OH-] = 7 нейтральне середовище
[H+] > [OH-] > 7 кисле середовище
[H+] < [OH-] < 7 лужне середовище
Гідроліз – це процес взаємодії солей з водою з утворенням слабкого електроліту, що як правило призводить до зміни рН.
Типи гідролізу:
І. Гідроліз солей утворених сильною кислотою і слабкою основою (по катіонно)
1. Записуємо дисоціацію солі:
CuCl2=Cu2++2Cl-
2. Вибираємо йон, що відповідає слабкому електролітові
Cu2+ слабкий йон
Cu2+ + H+ (OH)-→ (CuOH)+ + H+ > pH
3. В йонному рівнянні беремо лише одну молекулу води
CuCl2 + H2O→CuOHCl + HCl
ІІ. Гідроліз солей утворених слабкою кислотою та сильною основою (по аніонно)
Na2CO3↔2Na+ + CO32-
CO32- слабкий йон
CO32- + H+ (OH)-→(HCO3)- + (OH)- < pH
Na2CO3 + H2O→NaHCO3 + NaOH
ІІІ. Гідроліз солей утворених слабкою кислотою і слабкою основою:
NH3 ∙ H2O або NH4OH
NH4OH→NH4+ + OH-
CH3COONH4→ CH3COO- + NH4+
CH3COO- + NH4+ + H+(OH)-→CH3COOH + NH4OH pH≈7
Примітка: нерозчинні солі а також солі утворені сильною кислотою і сильною основою
НЕ ГІДРОЛІЗУЮТЬСЯ!!!
3. Величини, що характеризують кількісний склад розчину.
Умови утворення розчину:
1. Коли швидкість виділення рівна швидкості розчинення утворюються насичені розчини ΔG=0
2. Коли швидкість розчинення більша швидкості виділення утворюються ненасичені розчини ΔG→0
3. Коли швидкість виділення більша за швидкість розчинення утворюються перенасичені розчини ΔG=0
З акон
Генрі - Дальтона:
розчинність газу в рідині пропорційно
парціальному тиску цього газу над
акон
Генрі - Дальтона:
розчинність газу в рідині пропорційно
парціальному тиску цього газу над
![]() рідиною.
рідиною.
m=k∙p
m – маса газу.
p – тиск газу
к – коефіцієнт пропорційності
Чим вище температура, тим гірше розчиняється газ в рідині.
Насичений розчин → ненасичений розчин:
-
↑P
-
↓T0
-
+H20
Ненасичений розчин → перенасичений розчин
-
↓P
-
↑T
-
додати електроліт
 Масова частка W(x)
Масова частка W(x)
![]() (безрозмірна
величина)%
(безрозмірна
величина)%
Молярна концентрація С(х)
![]() моль/л
моль/л
Молярна концентрація
еквівалента
![]()
 моль/л
моль/л
Масова концентрація
![]()
![]() г/л
г/л
![]()
z - число еквівалент, визначення:
1. Кислоти: НnА z=n 1/z=1/n
2. Основи: Me(OH)m z=m 1/z=1/m
3. Солі: MenBA z=B*n 1/z=1/B*n
![]()
![]()
![]()
![]()
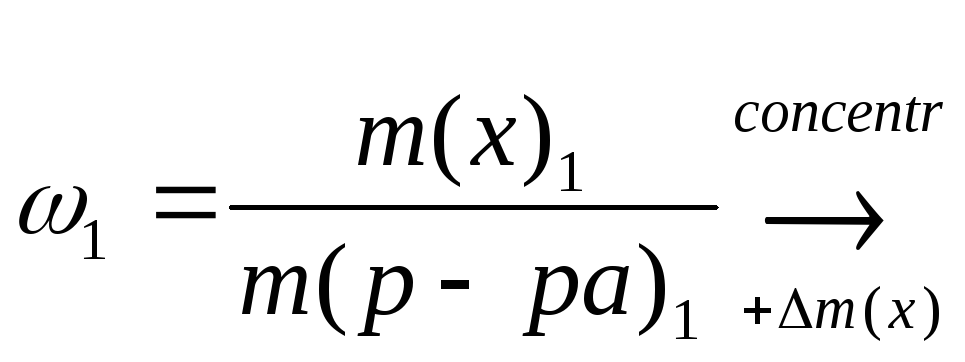
![]() формула для концентрації
розчину
формула для концентрації
розчину
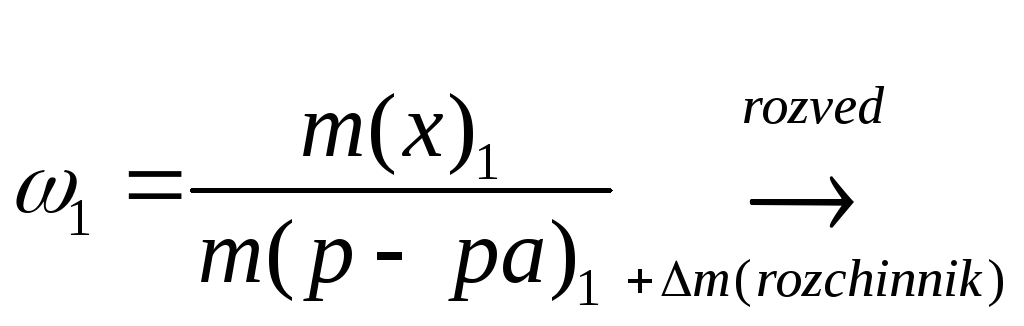
![]()
-
рН біологічних рідин (водневий показник)
H2O↔H+ + OH-
![]() моль/л
моль/л
![]()
![]()
[H+]*[OH-]=1,8*10-6моль/л*55,56моль/л=1*10-14моль г/л2 (йонний добуток води)
![]()
![]()
рН=-lg[H+] pOH=-lg[OH-]

pH+pOH=14 pH=14-pOH pOH=14-pH
[H+]=10-pH Приклад: [H+]=1*10-5 рН=5
[OH-]=10-pOH
![]()
![]()
α – ступінь дисоціації
n – кількість груп Н чи ОН в кислоті чи основі
7. Колігативні властивості розчинів
Це властивості, що залежать від кількості речовини в розчині, і не залежать від природи речовини.
Ізотонічний коефіцієнт Вант-Гофа показує в скільки разів більше кількість часточок у розчині електроліту порівняно із розчином неелектроліту.
Для неелектролітів і=1
Для електролітів:
![]()
![]()
![]()
Для електролітів
Збільшення температури кипіння
![]()
Зменшення температури замерзання
![]()
![]()
Ке =0,52кгК/моль – ебуліоскопічна стала
Кк =1,86кгК/моль – кріоскопічна стала

m(H2O)→[кг]
6. Буферні системи.
Механізми буферних систем:
|
1. Амонійний NH3∙H2O↔NH4+ + OH- NH4Cl→NH4+ + Cl- a) HCl→H+ + Cl- NH3∙H2O+HCl=NH4Cl+H2O NH3∙H2O+H+=NH4++H2O b) NaOH→Na++OH- NH4Cl + NaOH=NH3∙H2O+NaCl NH4+ +OH-=NH3∙H2O 2. Гідрокарбонати CO2∙H2O↔H+ + HCO3- NaHCO3→Na++HCO3- a) HCl→ H+ + Cl- NaHCO3+HCl=NaCl+CO2+ H2O HCO3-+H+=CO2+ H2O b) NaOH→ Na++OH- CO2∙H2O+NaOH=NaHCO3+H2O CO2∙H2O+OH-=HCO3-+H2O
|
3. Фосфатний NaH2PO4→Na++ H2PO4- Na2HPO4→2Na++ HPO42- a) HCl→ H+ + Cl- Na2HPO4+HCl→ NaH2PO4 +NaCl HPO42-+H+= H2PO4- b) NaOH→ Na++OH- NaH2PO4+NaOH= Na2HPO4+H2O H2PO4-+OH-= HPO42+H2O 4. Ацетатний CH3COOH↔ CH3COO- +H+ CH3COONa→ CH3COO- +Na+ a) HCl→ H+ + Cl- CH3COONa+HCl= CH3COOH+NaCl CH3COO- +H+= CH3COOH b) NaOH→ Na++OH- CH3COOH+NaOH= CH3COONa+H2O CH3COOH+OH-= CH3COO-+ H2O
|
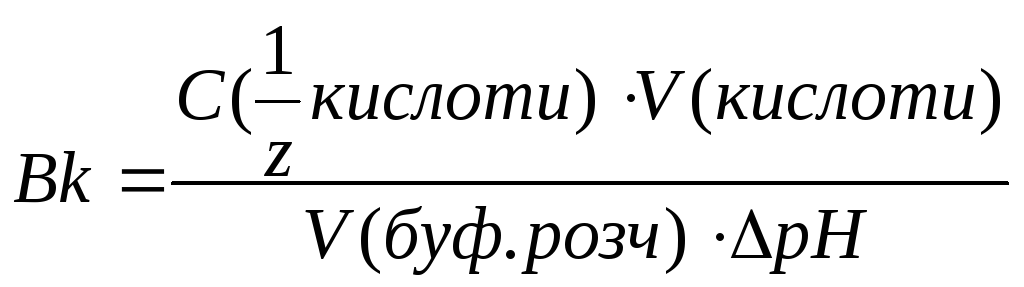
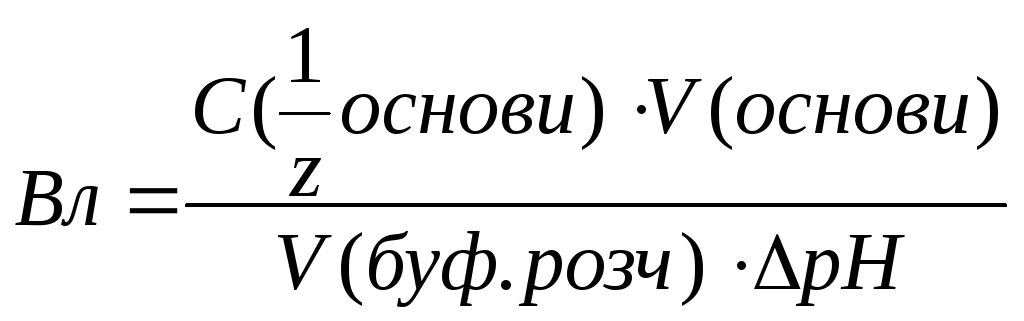
Вк – буферна ємність за кислотою;
Вл – буферна ємність за логом;
ΔрН – зміна рН буферної системи при додаванні кислоти (лугу)
Для кислотної буферної системи:
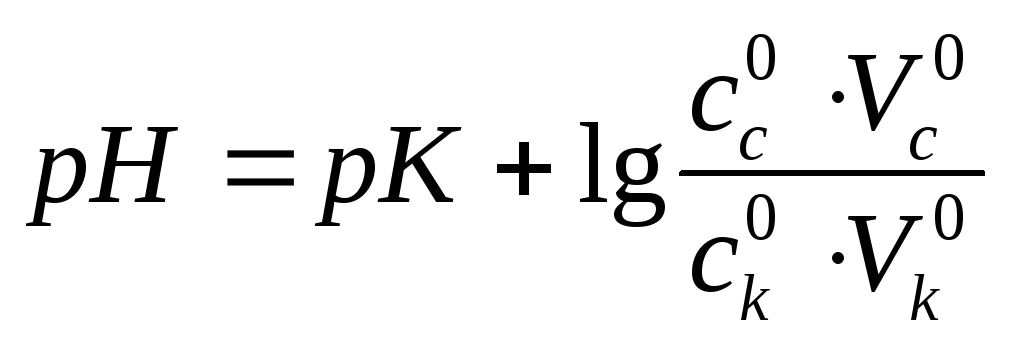 с – сіль, к – кислота.
с – сіль, к – кислота.
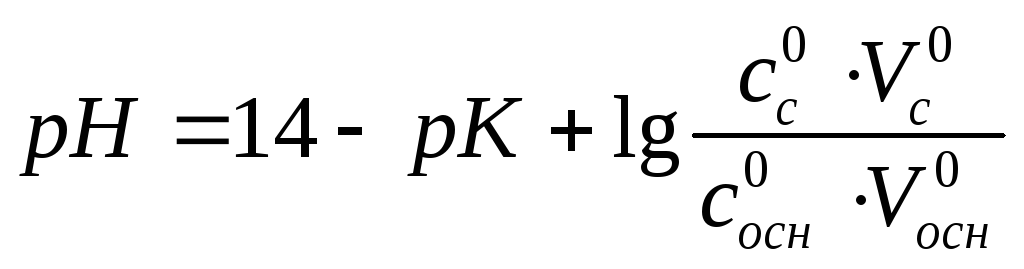 с – сіль, осн – основа.
с – сіль, осн – основа.
рК=-lgKд Кд – коеф дисоціації
 Амонійна – основна буферна система.
Амонійна – основна буферна система.
Всі інші – кислотні буферні системи.

![]()
![]()
![]()
![]()
