
- •Модуль 5 «Растворы» Лекция 23
- •Учение о растворах. Основные понятия
- •Способы выражения состава многокомпонентных систем и соотношения между ними
- •Равновесие жидкость-жидкость в двухкомпонентных системах
- •Равновесие пар (газ) – жидкость в двухкомпонентных системах
- •Давление насыщенного пара над идеальным раствором. Закон Рауля.
- •Давление насыщенного пара над бесконечно разбавленным раствором нелетучего вещества.
Модуль 5 «Растворы» Лекция 23
Растворы и их классификация. Строение жидких фаз. ТД теория растворов. Парциальные молярные величины. ТД функции смешения. Идеальные и предельно разбавленные растворы. Активности компонентов растворов. Уравнения Рауля и Генри.
Учение о растворах. Основные понятия
Раствором называется гомогенная смесь, состоящая из двух или большего числа веществ, состав которой может непрерывно изменяться в пределах области растворимости.
От гетерогенных смесей растворы отличаются размером частиц. Принимается, что истинный раствор образуют частицы с диаметром меньше 1 нм, а при размере частиц больше 100 нм они образуют гетерогенную смесь. Между истинными растворами и механическими смесями находятся коллоидные растворы. От химических соединений растворы отличаются переменностью состава и характером сил связи. В растворах это преимущественно не валентные, а ван–дер–ваальсовы взаимодействия, хотя в ряде случаев большое количество выделяющейся при растворении теплоты свидетельствует о возможном образовании химических соединений между компонентами раствора (например, в системе вода – серная кислота).
Образование раствора из компонентов является самопроизвольным процессом, при протекании которого в изобарно – изотермических условиях энергия Гиббса уменьшается (∆G<0), что может быть обусловлено энтальпийным и энтропийным вкладами.
Компоненты, при смешении которых получается раствор, изначально могут быть в различных агрегатных состояниях (газ – газ, газ – жидкость, жидкость – жидкость, жидкость – твердое, твердое –твердое). Образующиеся растворы могут быть газообразными, жидкими или твердыми.
Газообразные гомогенные системы при нормальных условиях образуются, как правило, в результате смешивания газов. Эти газовые смеси подчиняются закону Дальтона: парциальное давление i-го компонента смеси pi пропорционально его мольной доле Xi, а общее давление p равно сумме парциальных давлений компонентов:
pi = pX i ; ∑ pi = p .
Твердые растворы могут образовываться при кристаллизации жидких расплавов или при растворении газов в твердых веществах.
Наиболее распространенным типом твердых растворов являются растворы замещения, реже встречаются твердые растворы внедрения.
Твердые растворы замещения образуются, если атомы растворяющего А и растворяемого Б элементов по своим размерам отличаются незначительно; в этом случае в кристаллической решетке атомы элемента А частично замещаются атомами элемента Б (рис. 23.1, a). Если же атомы растворяемого элемента B заметно меньше атомов элемента А, то при кристаллизации расплава атомы вещества B размещаются в пустотах кристаллической решетки элемента А и образуется твердый раствор внедрения (рис. 23.1, b).
Вещества, образующие твердые гомогенные системы при любом соотношении компонентов (т. е. неограниченно растворимые друг в друге), встречаются редко (обычно это твердые растворы замещения). Достаточно редко встречаются и вещества, практически полностью не растворимые друг в друге в твердом состоянии. Чаще наблюдается ограниченная взаимная растворимость веществ, охватывающая более или менее широкий интервал составов.
Наиболее распространенным типом растворов являются жидкие гомогенные системы, образующиеся при растворении в жидкостях газов, твердых веществ и других жидкостей.

 a)
b)
a)
b)

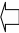
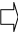
 Б
A
Б
A
B
Рис. 23.1. Схемы образования растворов замещения (a) и внедрения (b)
Газы и твердые вещества растворяются в жидкостях лишь до определенных концентраций. Когда химический потенциал растворяемого вещества в растворе становится равным его химическому потенциалу в чистом виде, растворение прекращается (∆G=0). При этом образуется насыщенный раствор. Если же оба компонента являются жидкостями, то нередко гомогенные системы (растворы) образуются при смешении их в любых пропорциях.
Жидкие растворы играют огромную роль в природе и технике, а учение о растворах представляет собой важный раздел физической химии.
Вследствие сложности и многообразия межчастичных взаимодействий в растворах, связанных с химическими свойствами индивидуальных элементов, исчерпывающей теории растворов в настоящее время не существует. Исключением являются некоторые простые классы растворов: идеальные, атермальные и регулярные, свойства которых могут быть вычислены на основании теоретических представлений.
Идеальными
называют растворы, в которых энергии
взаимод ействия
между однородными и разнородными
частицами связаны соотношением
ε
AB
= (ε AA
+ ε BB
)
/ 2 или ε AB
= ε AA
⋅
ε BB
. Идеальный раствор образуется без
поглощения и выделения теплоты и объем
раствора равен сумме объемов компонентов:
∆H смешения = 0 и ∆Vсмешения = 0 , а ∆S
смешения = −(∂∆G ∂T ) p . К таким растворам
можно отнести смеси сходных по химическому
составу веществ (например, бромбензол
— хлорбензол, гексан — гептан, и т.д.),
стереоизомеров, соседей по гомологическому
ряду, а также предельно (бесконечно)
разбавленные растворы, которые являются
идеальными по растворителю (добавление
растворителя в такой раствор не вызывает
выделения или поглощения теплоты).
ействия
между однородными и разнородными
частицами связаны соотношением
ε
AB
= (ε AA
+ ε BB
)
/ 2 или ε AB
= ε AA
⋅
ε BB
. Идеальный раствор образуется без
поглощения и выделения теплоты и объем
раствора равен сумме объемов компонентов:
∆H смешения = 0 и ∆Vсмешения = 0 , а ∆S
смешения = −(∂∆G ∂T ) p . К таким растворам
можно отнести смеси сходных по химическому
составу веществ (например, бромбензол
— хлорбензол, гексан — гептан, и т.д.),
стереоизомеров, соседей по гомологическому
ряду, а также предельно (бесконечно)
разбавленные растворы, которые являются
идеальными по растворителю (добавление
растворителя в такой раствор не вызывает
выделения или поглощения теплоты).
К числу простых систем можно отнести также растворы, у которых равны нулю не обе, а лишь одна из этих величин. Это регулярные растворы, у которых ∆Vсмешения = 0 и ∆S смешения = −(∂∆G ∂T ) p , но ∆H смешения ≠ 0 , и атермальные растворы, у которых ∆H смешения = 0 , но ∆Vсмешения ≠ 0 и ∆S смешения ≠ −(∂∆G ∂T ) p . Свойства таких растворов тоже могут быть вычислены на основе теоретических представлений.
