
- •Тау жыныстарын айналмалы бұрғылау қалай іске асырылады?
- •Таужыныстарын соққылап бұрғылау қалай іске асырылады?
- •Тау жыныстарын соққылап-бұрып бұрғылау.
- •Тау жыныстарын соқпа-айналымды бұрғылау.
- •Жарылғыш зат дегеніміз не?
- •Жарылыс реакциясының өту түрі.
- •Өнеркәсіптік жз-тар қандай қоспалардан тұрады?
- •Жарылыстың қандай түрлері болады?
- •Химиялық жарылыс д/з не?
- •Жз құрамдарына қоспалар қандай мақсатта қосылады?
- •Жз сипаттамаларын бағалау үшін қандай сынақ әдістері қолданылады?
- •Жарылғыш заттардың бризанттылығын анықтау.
- •Жарылғыш заттардың жұмыс істеуге қабілеттілігін анықтау.
- •Жз сезімталдығын анықтау.
- •Жарылғыш заттардың сапасын тексеру әдістері.
- •Құрғақ ұнтақталған жарылғыш заттар.
- •Құрамында суы бар жарылғыш заттар.
- •Жз оқтамдарын от арқылы қоздыру әдісінің ерекшеліктері.
- •От арқылы қоздыру әдісіндегі қолданылатын құралдар
- •Жарылғыш зат оқтамын электрлі-отты қоздыру әдісі.
- •Электрлі қоздыру әдісінің тиімділігі.
- •Электрлі қоздыру желісін жалғау әдістері.
- •Жз оқтамын дүмпіткіш пілте арқылы қоздыру әдісі.
- •Жарылғыш зат оқтамдары қандай белгілермен топталады?
- •Жарылыстан пайда болатын ұра көлемін қалай анықтауға болады?
- •Табан бойынша кедергі сызығы д/з не және оны қалай анықтайды?
- •Үйлер мен ғимараттарға байланысты зақымдану дәрежесі қалай белгіленеді?
- •Шпурлық оқтам д/з не, қолданылу орны.
- •Ұңғымалық оқтамды ашық кен жұмыстарында қолдану технологиясы.
- •Камералық оқтамдарды жербеті жағдайында қолдану әдісі.
- •Карьерлердегі ұңғымаларды қандай техникалармен оқтауға болады?
- •Камералық оқтамды дайындау үшін камераның көлемін қалай анықтайды?
- •Ұңғымаларды бос ауа аралықтарын қалдырып оқтаудың тиімділігі.
- •Ұңғымалар арақашықтығын қалай анықтайды?
- •Жерасты қазбаларының забойларында шпурлар қалай орналасады?
- •Шпурлардың тереңдігі қандай жағдайларға байланысты анықталады?
- •Бір аттыруға қолданылатын жз көлемі қалай анықталады?
- •Жарылғыш заттың меншікті шығыны д/з не?
- •Шпурларды пайдалану коэф?
- •Забойды қопаруға қолданылатын шпурлар саны қалай анықталады?
- •Электрлі қол бұрғыларының жұмыс принципі және қолданылатын орны.
- •Оттегілік баланс д/з не?
- •Оттегілік баланстың қандай түрлері болады?
- •Оттегілік балансты анықтауда аммиакты селитра қалай қолданылады?
- •Жарылыстан пайда болатын газдар қалай анықталады?
- •Нөлдік оттегілік баланс д/з не?
- •Жз жарылысынан пайда болатын газ көлемі қалай анықталады?
- •Жз жарылысынан пайда болатын қысымды қалай анықтауға болады?
- •Дүмпіткіш капсюль д/з не?
- •Отпілтенің құрылысы.
- •Тұтандырғыш түтік д/з не және ол қалай жасалады?
- •Электрлі-отты қоздыру жабдығы қалай жасалады?
- •Электрлі дүмпіткіш д/з не?
- •Лезде атылатын электрлі дүмпіткіштердің құрылысы.
- •Кідіріп атылатын электрлі дүмпіткіштердің ерекшеліктері.
- •Электрлі дүмпіткіштерге ток беретін құралдар.
- •Дүмпіткіш пілте құрылысы және қолданылатын орны.
- •Дүмпіткіш пілте аттыру желісін жалғау әдісі.
- •Жз оқтамын соққы толқынды қоздыру әдісі.
- •Соққы толқынды қоздыру әдісінің ерекшеліктері.
Оттегілік баланс д/з не?
Оттегілік баланстың қандай түрлері болады?
Жарылғыш зат молекулаларындағы жанғыш элементтердің толық тотығуы үшін қажетті оттегінің жеткілікті немесе жеткіліксіз екенін оттегілік баланс көрсетеді, оны пайызбен көрсетуге болады:
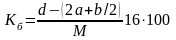 %;
%;
мұндағы 16 – оттегінің атомдық салмағы; М – жарылғыш заттың молекулалық массасы.
Оттегілік баланстың үш: оң (карьер бетінде), теріс және нөлдік түрі болады.
Егер ЖЗ құрамында жанғыш элементтерді толық тотықтыратын оттегі болса, онда – нөлдік оттегілік баланс деп аталады. Егер ЖЗ құрамындағы оттегі мөлшері жанғыш элементтерді толық тотықтыруға жеткіліксіз болса, теріс, ал оттегі аса көп болса, оң оттегілік баланс деп аталады.
Нөлдік оттегілік балансты, жарылғыш заттардың жарылысы кезінде негізінен су булары, көмір қышқылдары, еркін азот, алюминий тотығы және аз мөлшерде улы газдар бөлінеді. Оттегі жеткіліксіз болған жарылыс кезінде, көміртегінің улы қышқылы (СО) түзіледі. Бұл қоспаның құрылуы көміртегінің екі тотығымен салыстырғанда, жылудың аз бөлінуімен сипатталады. Оттегісі аса көп жарылғыш заттардың жарылысынан, азотпен байланысқан оттегінің өте улы тотықтары – NO, NO2, N2O3 бөлінеді. Сонымен, оттегілік балансы теріс және оң ЖЗ-тар жарылысының қуаты төмен болып келеді.
Жерасты қазба жұмыстары кезінде оттегілік балансы нөлге жақын (±3 %) ЖЗ қолданылуы керек.
Көміртегі тотығының улау әсері мына тәртіпте болады, яғни адам қанындағы оттегі тасымалдайтын денелермен араласып улы қоспа түзіледі. Соның әсерінен адамның ішкі мүшелеріне оттегі жетіспей, ол уланады. NO, NO2, N2O3 азот тотықтары адам тыныс алған кезде, оның өкпесіндегі сумен араласып азотты қышқыл түзеді, ол өкпенің ісінуіне әкеліп соқтырады. Сондықтан көміртегі тотығымен салыстырғанда, азот тотығы газдары 6,5 есе улы болып саналады. Бұл газдардан басқа, жарылыс кезінде күкіртті сутек H2S, күкіртті ангидрид SO2 түзілуі мүмкін. Бұл газдармен адам дем алған кезде оның тыныс жолдары зақымданады.
Оттегілік баланс, оттегінің артық немесе кем грамм-атомы мен жарылғыш заттың грамм-молекулалық массасының қатынасымен қарапайым түрде анықталады.
Сақтандырылмайтын ЖЗ оң, нөлдік; сақтандырғыш ЖЗ теріс.
Оттегілік балансты анықтауда аммиакты селитра қалай қолданылады?
Аммиакты селитраның жарылыс реакциясынан мынандай ажырауды көруге болады:
NH4NO3→2H2O+N2+[O];
яғни, селитраның 1 мольі байланыста жоқ (бос) бір грамм-атом оттегін шығарады. Сондықтан, нөлдік оттегілік балансты жасау үшін бұрын алынған компоненттерге аммиакты селитраның 197,21 мольін немесе 197,21·80=15777 г =15,78 кг қосу керек (мұндағы 80 г есептегендегі аммиакты селитраның бір мольінің салмағы).
Жарылғыш қоспа компоненттерінің салмақтық арақатынасы қосқан аммиакты селитраны есептегенде, пайыз бойынша мынандай болады.
Қоспаның барлық салмағы:
15,78+1+5+1,5=23,28 кг.
Пайыздық қатыстары:
Аммиакты селитраның 15,78·100/23,28=67,8 %;
Тротилдің 1·100/23,28=4,73 %;
Гексогеннің 5·100/23,28=21,5 %;
Алюминий ұнтағының 1,5·100/23,28=6,4 %.
Жарылғыш заттың оттегілік балансының нөлден ауытқуы. Әсіресе аммиакты селитралы жарылғыш заттардың теріс баланс кезінде – көміртегі тотығы, оң баланс кезінде – азот тотықтары пайда болады.
Оттегілік баланс, оттегінің артық немесе кем грамм-атомы мен жарылғыш заттың грамм-молекулалық массасының қатынасымен қарапайым түрде анықталады.
Қоспалы жарылғыш заттардың оттегілік балансын анықтау əрбір компонент үлесінің мəндерін қосу арқылы жүргізіледі.
Аммиакты селитра (NH4NO3)-атомдық н/е молекулалық массасы 80, Оттегілік балансы +20,0; жылу бөлуі 355 кДж/гмоль.
