
- •Демидюк
- •ПРИНЦИПЫ ОЧИСТКИ БЕЛКОВ
- •ХНОЛОГИЯ БЕЛКОВЫХ ПРЕПАРАТ
- •ЛИТЕРАТУРА
- •БЕЛКИ СОСТОЯТ ИЗ АМИНОКИСЛОТ
- •ЙСТВА АМИНОКИСЛОТ ОЧЕНЬ РАЗНООБРАЗ
- •ПРОСТРАНСТВЕННАЯ ОРГАНИЗАЦИЯ БЕЛКОВ
- •ОВЫЕ МОЛЕКУЛЫ АМФИФИЛЬНЫ И АМФОТ
- •ИЗОЭЛЕКТРИЧЕСКАЯ ТОЧКА БЕЛКОВ
- •И СИЛЬНО РАЗЛИЧАЮТСЯ ПО РАЗМЕРУ И Ф
- •ЕТОДЫ ФРАКЦИОНИРОВАНИЯ БЕЛКО
- •ХРОМАТОГРАФИЯ
- •Осы и пчелы
- •йшая система для колоночной жидкостной хроматог
- •Обращенно-фазовая хроматография
- •Гидрофобная хроматография
- •Ионообменная хроматография
- •Катионо- и анионообменники
- •АНИОНИТЫ КАТИОНИТЫ
- •ивые титрования катионо- и анионообменни
- •Гель-проникающая хроматография
- •Материалы для ГПХ
- •ределение молекулярной массы методом Г
- •ффинная (биоспецифическая) хроматограф
- •еры взаимодействий в аффинной хроматогр
- •Лиганды с индивидуальной специфичностью
- •Лиганды с групповой специфичностью
- •3. Нуклеозид
- •4. Триазиновые красители
- •. Лиганды для протеаз
- •6. Олиго(dT) и полиуридировая кислота
- •Металлохелат аффинная хроматография
- •Металлохелат аффинная хроматография
- •Методы элюции
- •ЕТОДЫ ФРАКЦИОНИРОВАНИЯ БЕЛКО
- •ЕКТРОФОРЕТИЧЕСКИЕ МЕТОДЫ РАЗДЕЛЕН
- •Скорость движения идеализированной
- •Гель-электрофорез
- •Полиакриламидный гель
- •Агарозный гель
- •Агарозный и полиакриламидный гели
- •Вертикальный и горизонтальный электрофорез
- •Вертикальный электрофорез
- •Изоэлектрическое фокусирование
- •еление белков по размера с использованием
- •Гель-электрофорез: как это выглядит
- •ЕТОДЫ ФРАКЦИОНИРОВАНИЯ БЕЛКО
- •Центрифугирование –
- •Разделение осаждением
- •Диализ и ультрафильтрация
- •ЕТОДЫ ФРАКЦИОНИРОВАНИЯ БЕЛКО
- •СТРАТЕГИЯ ОЧИСТКИ БЕЛКОВ
- •ОСОБЕННОСТИ МЕТОДОВ РОМАТОГРАФИЧЕСКОГО РАЗДЕЛЕНИЯ СПОЛЬЗОВАНИИ ИХ ДЛЯ ОЧИСТКЕ БЕ
- •МЕЖДУ ЧЕТЫРЕХ ОГНЕЙ
- •ТКА РЕКОМБИНАНТНЫХ ВАРИАНТОВ ГЛУТАМИЛЭНДОПЕПТИ
- •ТЕЛЬЦА ВКЛЮЧЕНИЯ
- •чистка металлопротеазы термоактиномицет
- •Вопросы для
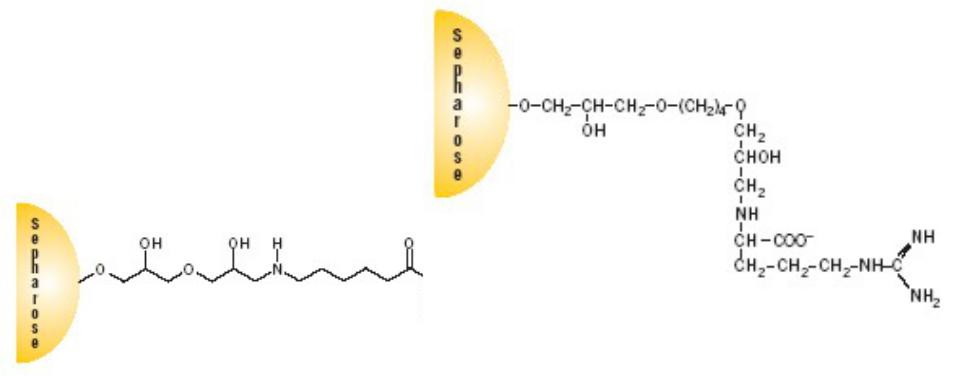
. Лиганды для протеаз
протеаз могут служить главным образом аналоги субстратов и ингибиторы. Коммерчески доступны сорбенты для протеаз несущие в качестве лигандов
аминокислоты и пептиды (аргинин, триптофан, Аla-Ala-Ala), аналоги субстратов (Gly-Tyr-азобензилянтарная кислота), синтетические и природные ингибиторы трипсина (п-аминобензамидин) и химотрипсина, ингибитор кислых протеиназ пепстатин, природные антибиотики
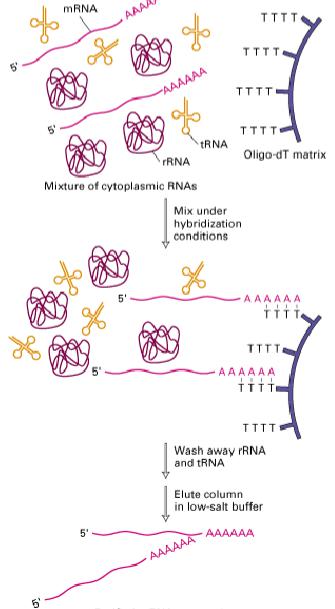
6. Олиго(dT) и полиуридировая кислота
на своем 3'-конце более или менее протяженную полиадениновую последовательность (средняя длина – около 100 адениловых остатков). Это обстоятельство дало возможность создать аффинный сорбент с групповой специфичностью к любой молекуле мРНК, содержащей такую последовательность. На матрице закрепляют комплементарный гомополимер олиго(U) или олиго(dT) длиной около 100 остатков. Наиболее распространённый сегодня коммерческий сорбент Oligo(dT)- Cellulose (GE Helthcare, NEB,
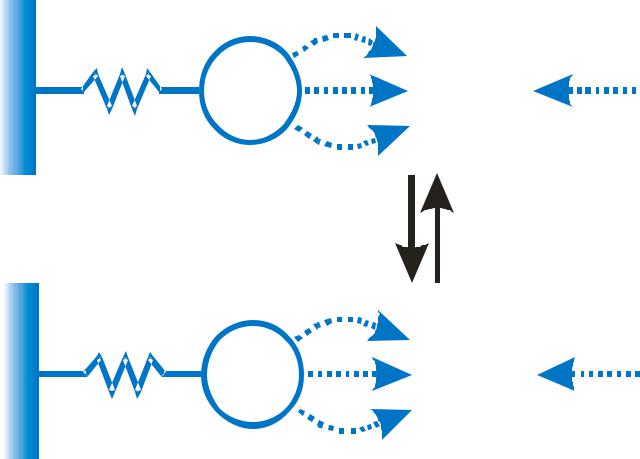
Металлохелат аффинная хроматография
Л Men+ |
Y + XБ |
Л Men+ |
XБ +Y |
– хелатообразующий стационарный лиганд еn+ – ион металла
–обмениваемый подвижный лиганд
Б– белок с электронодонорной координирующей группо
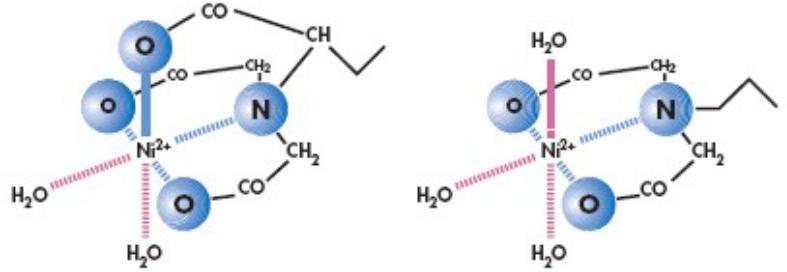
Металлохелат аффинная хроматография
Cтационарные
Нитрилотриуксусная кислота |
Иминодиуксусная кислота |
(НТК, NTA) |
(ИДК, IDA) |
Металлы: Cu2+, Ni2+, Fe3+, Co2+, Zn2+
Основной вклад в связывание белка вносят остатки
His.
Стандартным подходом является введение в
рекомбинантные белки гистидиновых (чаще всего His6) последовательностей (якорей, тагов) для
упрощения процедуры очистки
Вклад в связывание вносят также остатки Cys и
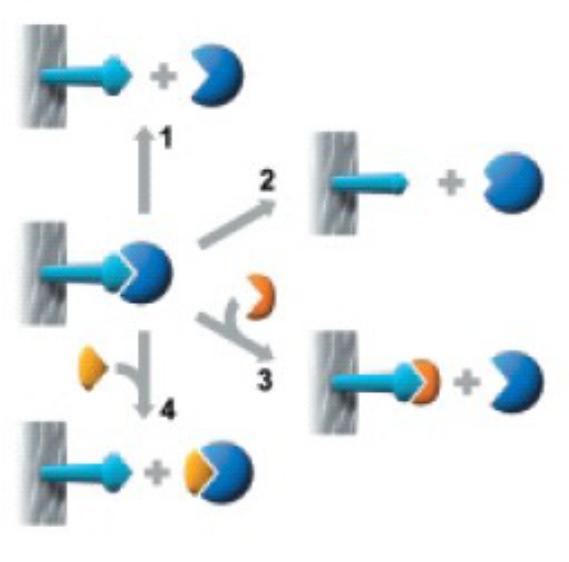
Методы элюции |
Method 1 |
|
The simplest case. A change of |
|
buffer composition elutes the |
|
bound substance without |
|
harming either it or the ligand. |
Method 2
Extremes of pH or high concentrations of chaotropic agents are required for elution, but these may cause permanent or temporary damage.
Methods 3 and 4
Specific elution by addition of a substance that competes for binding. These methods can enhance the specificity of media that use group-specific ligands.

ЕТОДЫ ФРАКЦИОНИРОВАНИЯ БЕЛКО
СВОЙСТВО
БЕЛКА
ЗАРЯД
ГИДРОФОБНО
СТЬ/ГИДРОФИ
ЛЬНОСТЬ
РАЗМЕР
МЕТОД РАЗДЕЛЕНИЯ
ХРОМАТОГРАФИ
Я
ИОНООБМЕННАЯ (ИОХ, IEX) [АФФИННАЯ (АХ, AC)]
ГИДРОФОБНАЯ (ГХ, HIC) ОБРАЩЕННО ФАЗОВАЯ (ОФХ, RPC) [АФФИННАЯ (АХ, AC)]
ГЕЛЬПРОНИКАЮЩ
АЯ
(ЭКСКЛЮЗИОННАЯ , ГПХ, SEC)
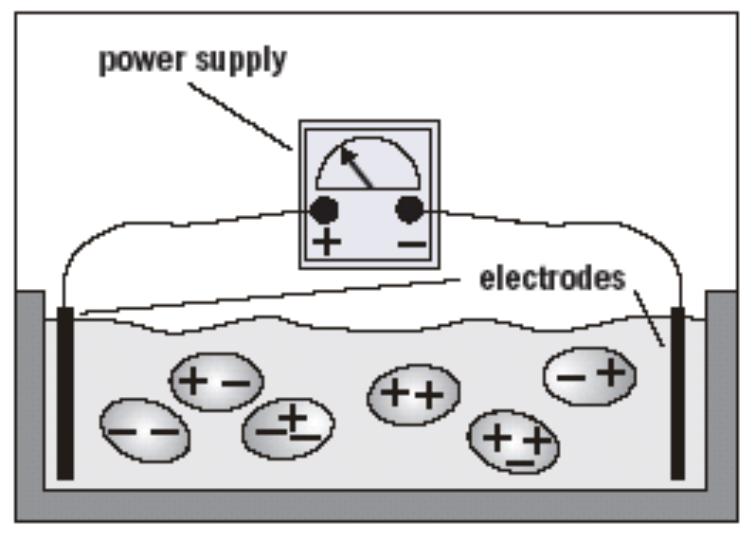
ЕКТРОФОРЕТИЧЕСКИЕ МЕТОДЫ РАЗДЕЛЕН
Электрофорез – перемещение заряженных молекул под действием электрического поля к катоду или аноду в зависимости от знака их суммарного заряда.

Скорость движения идеализированной
сферической частицы в электрическом поле
v zE
6 r
z - заряд частицы E - напряженность электрического поля- вязкость среды
r- радиус частицы
Скорость движения частиц (см/мин) при напряженности электрического поля 1 В/см называется электрофоретической подвижностью. Она имеет размерность см2·мин-1·В-1, а ее знак совпадает со знаком суммарного заряда. Различия в подвижности частиц служит основой для разделения смесей методом электрофореза.
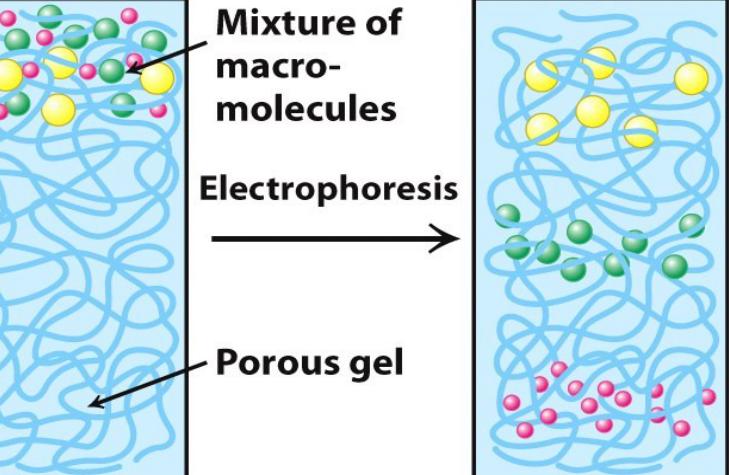
Гель-электрофорез
Использование гелей в качестве поддерживающей
среды позволяет стабилизировать электрофоретические зоны и обеспечивает эффект
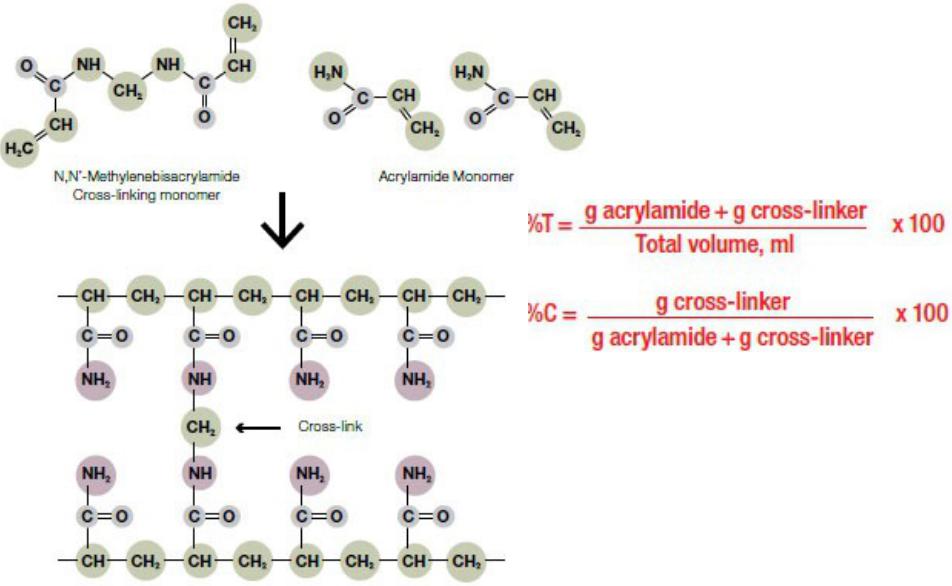
Полиакриламидный гель
Акриламид – мономер, формирующий
линейные цепи
N,N’- метиленбисакрилами д – поперечно- сшивающий мономер
Т = 5-15% С = 2-5%
(CH3)2N-CH2-CH2-N(CH3)2
ТЕМЕД – катализатор
(N,N,N’,N'- тетраметилэтилендиами
(NH4)2S2O8
Персульфат аммония – инициатор полимеризации
