
- •Ферменты, используемые в ги: днк-полимераза 1, концевая днк-трансфераза, поли-(а)-полимераза (все есть в книге)
- •Пцр, принципы метода.
- •Методы сайт-направленного мутагенеза с использованием пцр.
- •Общая характеристика векторов для экспрессии чужеродных белков в e. Coli.
- •Регуляция экспрессии лактозного оперона.
Вопросы к экзамену.
-
Строение гена и биосинтез белка в прокариотической клетке.
Прокариоты – одноклеточные организмы, лишенные ядра, с хромосомами, находящимися в цитоплазме.
Ген – участок ДНК, кодирующий одну полипептидную цепь или одну молекулу tРНК, rРНК или sРНК
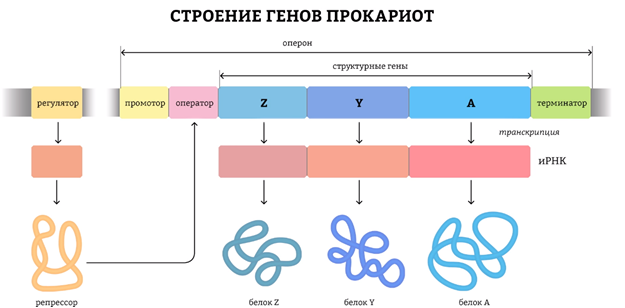
Гены прокариот состоят из двух основных элементов: регуляторной части и собственно кодирующей части. Регуляторная часть обеспечивает первые этапы реализации генетической информации, а кодирующая часть содержит информацию о структуре полипептида, тРНК, рРНК. У прокариот структурные гены, кодирующие белки одного метаболического пути, часто бывают объединены и называются опероном. Оперон – это участок ДНК, ограниченный с одной стороны промотором (местом присоединения РНК-полимеразы), с другой – терминатором (местом ее отсоединения). Оперон кодирует одну молекулу мРНК, на основе которой позже могут синтезироваться один или несколько белков. В опероне имеется оператор, “разрешающий” или “не разрешающий” работу РНК-полимеразы
У прокариот большинство генов “включено” (с них идет синтез белков), поэтому задача регуляции у них чаще всего сводится к их “выключению” с помощью веществ-репрессоров, причем один определенный репрессор влияет только на свой ген (или на небольшую группу генов) и не действует на другие. Упрощает регуляцию синтеза белка прокариотами наличие у них координированной регуляции: если несколько разных цистронов (то есть генов, кодирующих белки) регулируются одной регуляторной зоной (промотор + оператор), то воздействием на эту зону можно регулировать синтез сразу всех белков, закодированных этими цистронами.
Начало синтеза у прокариот и эукариот существенно различается. Это связано с тем, что у прокариот гены собраны в «пачки» для удобства регуляции. У них полицистронный принцип организации генов, при котором одна длинная информационная РНК считывается сразу с нескольких генов, участвующих в одном биохимическом процессе. Это удобно для регулирования процессов внутри клетки.
Прокариоты в большинстве случаев используют негативную регуляцию, через ген-специфичные репрессоры, действующие на промоторы структурных генов.
У прокариот, в отличие от эукариот, транскрипция и трансляция происходят в одном месте и в одно время. У них нет ядра, поэтому синтез белка может начинаться еще до окончания синтеза РНК. РНК-полимераза может считывать полицистронную мРНК, по матрице которой одновременно может начаться синтез белка.

В связи с тем, что гены прокариот не имеют экзонов и интронов (исключение — гены архебактерий), располагаются группами, и на эту группу генов приходится один промотор, появляются следующие особенности транскрипции и трансляции у прокариот.
1. В результате транскрипции образуется полицистронная иРНК, кодирующая несколько белков, совместно обеспечивающих определенную группу реакций.
2. иРНК имеет несколько центров инициации трансляции, терминации трансляции и НТО.
3. Не происходят КЭПирование, полиаденилирование и сплайсинг иРНК.
4. Трансляция начинается еще до завершения транскрипции; эти процессы не разделены во времени и пространстве, как это имеет место у эукариот.

1 — ДНК; 2 — РНК-полимераза; 3 — Нуклеозидтрифосфаты ГТФ, ЦТФ, АТФ, УТФ.
Можно добавить, что срок «жизни» прокариотических иРНК — несколько минут (у эукариот — часы и даже сутки).
-
Регуляторные элементы в ДНК: промоторы, терминаторы, участок Шайн-Далгарно, инициирующие и терминирующие кодоны, ori.
Промотор – последовательность нуклеотидов ДНК, узнаваемая РНК-полимеразой как стартовая площадка для начала транскрипции. Промотор играет одну из ключевых ролей в процессе инициации транскрипции.
Коровая РНК-полимераза бактерий (состоящая из субъединиц α2ββ'ω) может инициировать транскрипцию в любом месте генома. Однако, в клетке инициация происходит только в промоторных участках. Такая специфичность обеспечивается σ-субъединицей (σ-фактор), которая в комплексе с коровым ферментом образует холофермент. Основным σ-фактором клеток Escherichia coli является σ70-субъединица.

Классический (σ70) промотор представляет собой две консервативные последовательности длиной по 6 нуклеотидов, расположенные выше сайта начала транскрипции на 10 и 35 п.о., разделенные 17 нуклеотидами. Эти последовательности называются соответственно -10 и -35 элементами. Элементы не идентичны во всех промоторах, но для них можно получить консенсусные последовательности.
Некоторые сильные промоторы также имеют UP-элемент, расположенный выше -35-элемента, который повышает уровень связывания РНК-полимеразы. Некоторые σ70 промоторы не имеют -35-элемента, зато имеют -10-элемент, расширенный вверх на несколько нуклеотидов (extended -10). Таков промотор галактозного оперона E.coli. Иногда ниже -10-элемента располагается ещё один связывающий элемент – дискриминатор.



Терминатор (англ. Terminator) — нуклеотидная последовательность ДНК, на которой завершается транскрипция гена или оперона. Как правило, последовательность терминатора такова, что комплементарная ей последовательность в мРНК вызывает выход новосинтезированного транскрипта из транскрипционного комплекса. Эта последовательность в мРНК может сама по себе вызывать терминацию за счёт собственной вторичной структуры, а может привлекать особые белки — факторы терминации. После высвобождения РНК-полимераза и транскрипционные факторы приступают к транскрипции другого гена.
У прокариот существует два механизма терминации: ро-зависимый и ро-независимый.
Ро-зависимые терминаторы функционируют посредством особого белка — ро-фактора, который обладает РНК-хеликазной активностью и разрушает комплекс ДНК, мРНК и РНК-полимеразы. Ро-зависимые терминаторы встречаются у бактерий и фагов. Ро-зависимые терминаторы находятся ниже стоп-кодона, на котором завершается трансляция, и представляют собой неструктурированные, обогащённые цитозином последовательности в мРНК, известные как rut-сайты (от англ. Rho utilization site), после которых находятся точки остановки транскрипции (англ. tsp от transcription stop point). Консенсусная последовательность для rut-сайтов не установлена. Rut-сайт выступает в роли места посадки ро-фактора на мРНК и его активатора. Активированный ро-фактор начинает гидролизовать АТФ и за счёт энергии гидролиза движется вдоль мРНК, пока не столкнётся с РНК-полимеразой. Контакт между ро-фактором и РНК-полимеразой стимулирует распад транскрипционного комплекса за счёт аллостерических эффектов ро-фактора на РНК-полимеразу.
Ро-независимые терминаторы формируют шпильки в структуре синтезирующегося транскрипта, которые при столкновении с РНК-полимеразой вызывают диссоциацию комплекса ДНК, мРНК и РНК-полимеразы. Типичный ро-независимый терминатор состоит из 20 нуклеотидов, обогащён парами GC и обладает диадной симметрией, а вслед за ним следует обогащённый тимином участок (поли(Т)-тракт), которому в мРНК соответствует участок, обогащённый урацилом. Предположительный механизм работы ро-независимых терминаторов заключается в том, что шпилька вызывает остановку РНК-полимеразы, из-за которой повышается вероятность диссоциации фермента от матрицы.


Старт-кодон или инициаторный кодон — первый кодон матричной РНК, c которого начинается трансляция белка в рибосоме. У эукариот и архей старт-кодон всегда кодирует метионин, а у бактерий — модифицированный метионин (N-формилметионин). В большинстве случаев роль инициаторного кодона играет триплет AUG. Старт-кодону предшествует 5′-нетранслируемая область (5'-UTR). В 5'-UTR бактерий локализована последовательность Шайна — Дальгарно (AGGAGG), которая служит для связывания рибосомы и отделёна спейсером от старт-кодона.

Альтернативные старт-кодоны отличаются от стандартного кодона AUG. Такие кодоны встречаются как у прокариот, так и у эукариот. Альтернативные старт-кодоны обычно кодируют метионин, когда они находятся в начале белка (даже если кодон кодирует другую аминокислоту). Так например, кодон GUG кодирует валин в случае, если он находится внутри кодирующей последовательности, и стартовый метионин, если расположен в начале последовательности. Это происходит потому, что для инициации трансляции используется специальная транспортная РНК. Антикодоном инициирующей аминоацил-тРНК всегда является CAU; он полностью комплементарен основному старт-кодону AUG и частично комплементарен более редким кодонам. Кроме частично комплементарных GUG и UUG в исключительных случаях, особенно в клетках бактерий, инициация может начинаться с триплетов AUU, AUA, ACG и CUG. Эти так называемые «слабые» кодоны могут выполнять свою функцию в комбинации с сильными последовательностями Шайна-Дальгарно или другими структурными элементами, способствующими инициации.
Последовательность Шайна — Дальгарно (англ. Shine-Dalgarno sequence, Shine-Dalgarno box) — сайт связывания рибосом на молекуле мРНК прокариот, обычно на расстоянии около 10 нуклеотидов до стартового кодона AUG. Описана австралийскими учёными Джоном Шайном и Линн Дальгарно.
Консенсусом является последовательность из шести нуклеотидов AGGAGG; в случае E. coli последовательность Шайна — Дальгарно — AGGAGGU. Комплементарная последовательность CCUCCU, называемая последовательностью анти-Шайна — Дальгарно, располагается на 3'-конце молекулы 16S рибосомной РНК. Комплементарное взаимодействие между последовательностями Шайна — Дальгарно и анти-Шайна — Дальгарно служит для помещения старт-кодона мРНК в P-сайт рибосомы для начала биосинтеза белка.

Мутации в последовательности Шайна — Дальгарно снижают эффективность трансляции. Это обусловлено снижением эффективности образования комплекса мРНК-30S рибосомная субъединица. Показано, что комплементарные мутации в последовательности анти-Шайна — Дальгарно обеспечивают восстановление эффективности трансляции.
В момент образования комплекса последовательности Шайна — Дальгарно и анти-Шайна — Дальгарно, с 30S-рибосомной субъединицей связываются и факторы инициации трансляции IF2-GTP, IF1, IF3, а также инициаторная формилметионил-тРНК (fMet-tRNA). К образовавшемуся преинициаторному комплексу затем присоединяется 50S-рибосомная субъединица.
Стоп-кодон или кодон терминации — единица генетического кода, тройка нуклеотидных остатков (триплет) в ДНК — кодирующая прекращение (терминацию) синтеза полипептидной цепи (трансляцию).
Стоп-кодоны выполняют важную функцию завершения (терминацию) сборки полипептидной цепи и также называются терминаторными кодонами. Некоторые из них вызывают обязательное прекращение синтеза, другие являются условными.
Кроме того, стоп-кодон, как кодон, при котором не происходит включения аминокислоты в белок, ещё называют бессмысленным кодоном или нонсенс-кодоном.
Так, кодон UAG (Янтарь) — условный терминаторный кодон и супрессируемые Amber-мутации вызывают преждевременную терминацию трансляции (условно летальные мутации).
Сквозная трансляция может проходить через кодоны UAG (Янтарь) и UGA (Опал), но не через кодон UAA (Охра).
Кодоны UAA и UAG в митохондриальной ДНК вызывают безусловное прекращение трансляции.
Некоторые мРНК в действительности содержат два тандемных терминаторных кодона — часто это кодоны различного типа на конце кодирующей последовательности.
Точка начала репликации (англ. origin of replication = ori) — это фрагмент молекулы нуклеиновой кислоты, с которого начинается её репликация. Структура точки начала репликации (нуклеотидная последовательность) отличается у разных видов, но у всех организмов это АТ-богатая и потому легкоплавкая последовательность. Точка начала репликации и прилегающие к ней фрагменты нуклеиновой кислоты, не отделённые сайтами терминации, составляют единицу репликации — репликон. Репликация ДНК может начинаться от точки начала репликации в одном или двух направлениях.
Хромосомы и плазмиды прокариот содержат одну, реже несколько точек начала репликации ДНК; хромосомы эукариот имеют множество таких точек. Также точки начала репликации РНК обнаружены у РНК-содержащих вирусов, например, у вирусов, содержащих двуцепочечные РНК.


-
Передача и изменение генетической информации: трансформация, конъюгация, трансдукция, рекомбинация, мутации, репарация.
В основе генотипической изменчивости лежат мутации и рекомбинации.
1. Мутации - внезапные, скачкообразные изменения наследственных свойств. Основу этого явления составляют качественные или количественные изменения последовательности нуклеотидов в ДНК, которые могут возникать при жизнедеятельности организмов под влиянием внешних и внутренних факторов. Организмы с измененными признаками называются мутантами.
Различают спонтанные и индуцированные мутации.
• Спонтанные (самопроизвольные) мутации возникают под влиянием неизвестных причин. Частота спонтанных мутаций мала. Спонтанные мутации служат основным источником естественной изменчивости микроорганизмов и лежат в основе эволюции.
• Индуцированные (направленные) мутации проявляются в результате обработки микроорганизмов специальными мутагенами (физическими факторами и химическими веществами). В основе механизма лежит прямое или косвенной влияние на ДНК.
2. Рекомбинация
Перестройка заключенной в молекулах ДНК генетической информации осуществляется благодаря протеканию многих разнообразных процессов, обобщенно называемых генетической рекомбинацией.
Выделяют три основных типа генетической рекомбинации.
Гомологичная генетическая рекомбинация (общая рекомбинация) представляет собой обмен генами между двумя любыми молекулами ДНК (или участками одной и той же молекулы), которые содержат протяженные отрезки почти идентичной последовательности. Последовательности могут быть любыми, главное, чтобы они были похожими. При сайт-специфической рекомбинации происходят обмен только определенных последовательностей ДНК. Транспозиция ДНК отличается от двух других типов генетической рекомбинации тем, что в ней обычно участвует короткий участок ДНК, обладающий способностью перемещаться по хромосоме с одного сайта на другой.
Функции систем генетической рекомбинации так же разнообразны, как и их механизмы. К ним относится участие в специализированных системах репарации ДНК, определенная активность при репликации ДНК, регуляция экспрессии некоторых генов, облегчение расхождения хромосом при делении эукариотических клеток, поддержание генетического разнообразия и реализация запрограммированных генетических перестроек в ходе эмбрионального развития.
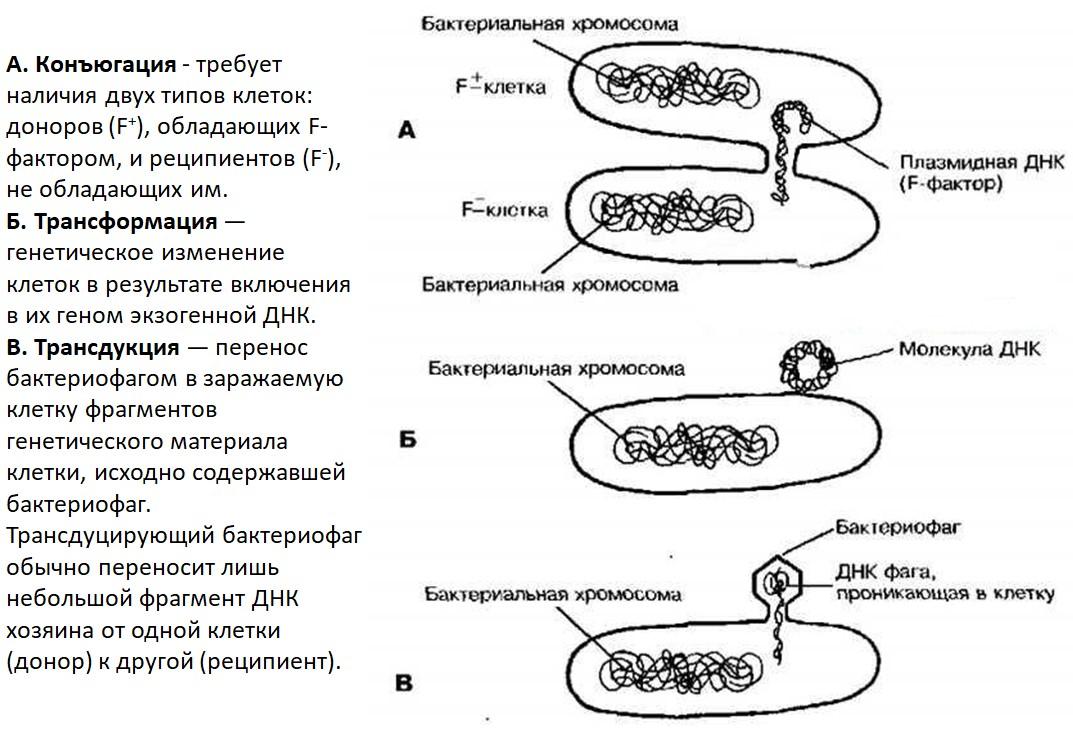
Трансформация - направленный перенос генетической информации от донорских клеток в реципиентные с помощью изолированной ДНК. При этом в хромосому реципиента включается только одна нить ДНК донора с образованием молекулярной гетерозиготы.
Конъюгация - форма полового процесса, при котором происходят соединение мужской и женской микробных клеток и обмен между ними ядерным веществом через цитоплазматический мостик, образующийся между клетками. При этом генетический материал клетки-донора переходит в клетку-реципиент. После рекомбинации и деления клетки образуются формы с признаками конъюгирующих клеток.
Трансдукция – перенос генетической информации из одной бактериальной клетки в другую с помощью бактериофагов.
Таким образом, все три формы комбинативной изменчивости одинаковы по существу. При трансформации участок ДНК клетки-донора входит в клетку-реципиент; при трансдукции эту роль выполняет фаг, а при конъюгации перенос генетической информации осуществляется через цитоплазмитический мостик (пили).
Вследствие генетических рекомбинаций образуются новые бактериальные клетки – рекомбинанты, у которых имеются наследственные признаки обоих «родителей».
3. Репарация - особая функция клеток, заключающаяся в способности исправлять химические повреждения и разрывы в молекулах ДНК, повреждённых при нормальном биосинтезе ДНК в клетке или в результате воздействия физических или химических реагентов. Осуществляется специальными ферментными системами клетки.
Каждая из систем репарации включает следующие компоненты:
 • ДНК-хеликаза
— фермент, «узнающий» химически
изменённые участки в цепи и осуществляющий
разрыв цепи вблизи от повреждения;
• ДНК-хеликаза
— фермент, «узнающий» химически
изменённые участки в цепи и осуществляющий
разрыв цепи вблизи от повреждения;
• ДНКаза (дезоксирибонуклеаза) — фермент, "разрезающий" 1 цепочку ДНК (последовательность нуклеотидов) по фосфодиэфирной связи и удаляющий повреждённый участок: экзонуклеаза работает на концевые нуклеотиды 3` или 5`, эндонуклеаза - на нуклеотиды, отличные от концевых;
• ДНК-полимераза — фермент, синтезирующий соответствующий участок цепи ДНК взамен удалённого;
• ДНК-лигаза — фермент, замыкающий последнюю связь в полимерной цепи и тем самым восстанавливающий её непрерывность.
У бактерий имеются по крайней мере 3 ферментные системы, ведущие репарацию — прямая, эксцизионная и пострепликативная. У эукариот к ним добавляется ещё Mismatch и SOS-репарация.
• Прямая репарация
Прямая репарация — наиболее простой путь устранения повреждений в ДНК, в котором обычно задействованы специфические ферменты, способные быстро (как правило, в одну стадию) устранять соответствующее повреждение, восстанавливая исходную структуру нуклеотидов.
• Эксцизионная репарация
Эксцизионная репарация (англ. excision — вырезание) включает удаление повреждённых азотистых оснований из ДНК и последующее восстановление нормальной структуры молекулы по комплементарной цепи. Ферментативная система удаляет короткую однонитевую последовательность двунитевой ДНК, содержащей ошибочно спаренные или поврежденные основания, и замещает их путём синтеза последовательности, комплементарной оставшейся нити.
• Пострепликативная репарация
Tип репарации, имеющей место в тех случаях, когда процесс эксцизионной репарации недостаточен для полного исправления повреждения: после репликации с образованием ДНК, содержащей повреждённые участки, образуются одноцепочечные бреши, заполняемые в процессе гомологичной рекомбинации при помощи белка RecA.
-
Этапы получения сверхпродуцентов методами ГИ.
-
Система модификации-рестрикции. Рестриктазы, метилазы: номенклатура, классы рестриктаз.
Эндонуклеазы - группа ферментов, относящихся к классу гидролаз, катализирующих реакцию гидролиза нуклеиновых кислот.
В отличие от экзонуклеаз, рестриктазы расщепляют нуклеиновые кислоты не с конца молекулы, а в середине. При этом каждая рестриктаза узнаёт определённый участок ДНК длиной от четырёх пар нуклеотидов и расщепляет нуклеотидную цепь внутри участка узнавания или вне его.
Модификация заключается в метилировании определенных оснований в последовательности, узнаваемой сопряженной рестриктазой; тем самым обеспечивается защита данного участка ДНК от воздействия рестриктазы. Одновременное наличие в клетке этих двух ферментативных активностей (так называемая R-M система) препятствует гидролизу собственной нуклеиновой кислоты. Чужеродная же ДНК при проникновении в бактериальную клетку служит субстратом для обоих ферментов.
Первоначально многие считали, что единственной функцией R-M систем является защита клеток от инфицирования фагами. Однако дальнейшие исследования позволили сделать предположение о том, что R-M системы осуществляют функцию ограничения скрещивания между различными бактериальными видами и штаммами, которая, однако, не абсолютна и по-зволяет части чужеродной ДНК проникать в клетку, рекомбинационно встраиваться и поддерживаться в качестве генетического фонда для получения эволюционного преимущества. Уместно заметить, что у бактерий весьма проблематично определение вида. Существуют даже предположения об общем генофонде всех микроорганизмов, что должно было бы привести к бесконечному появлению новых видов бактерий во времени. Реально же мы видим, что бактерии проявляют определенное постоянство морфологических, генетических и биохимических характеристик: Достойными кандидатами для обеспечения в эволюции относительной стабильности генетического материала, т. е. для осуществления генетической изоляции, не отрицающей обмена определенными блоками, являются системы рестрикции-модификации.
Системы рестрикции и модификации найдены практически у всех исследованных бактерий. Недавно рестриктазы обнаружены и у некоторых видов дрожжей.
В 1968 г. М. Мезельсон и Р. Юань сообщили о выделении первой рестриктазы из штамма Е. coli К12. Подобный фермент был получен и из штамма Е. coli В. Данные эндонуклеазы ЕсоК и ЕсоВ отличались высокой специфичностью по отношению к узнаваемой последовательности нуклеотидов, yо расщепляли молекулы ДНК неспецифическив другом месте, отстоящем от участка (сайта) узнавания. В 1970 г. X. Смит иК. Вилькокс выделили из Haemophius influenzae рестриктазу HindII, не только специ-фически узнающую, но испецифически расщепляющую молекулы ДНК. При гидролизе вирусной или плазмидной ДНК рестриктазами такого типа образуется строго определенный набор фрагментов. Это наглядно выявляется при электрофоретическом разделении смеси получающихся фрагментов.
Принципиальное значение для разработки методологии генетической инженерии имело открытие в 1971 г. Р. Ёшимори рестриктаз EcoR I и EcoR II. Спомощью первой из них удалось выполнить пионерскую работу по направленной реконструкции генетического материала in vitro. В настоящее время рестриктазы используют практическиво всех генно-инженерных экспериментах. Такое широкое применение ферментов данного типа обусловлено их высокой специфичностью, а также особенностями структуры концов фрагментов ДНК, образуемых рестриктазами. Общепринято термины рестриктаза, эндонуклеаза рестрикции, сайтспецифическая эндодезоксирибонуклеаза считать синонимами.
X. Смит и Д. Натане в 1973 г. предложили номенклатуру рестриктаз, которая включает следующие пункты:
1.Название каждого фермента является производным от бинарного родо-видового обозначения микроорганизма-хозяина, содержащего данную R-M систему, и составляется по следующему правилу: к первой прописной букве названия рода добавляют две первые строчные буквы вида. Например: Streploinyces albiis - Sal, Escherichia coli - Eco.
2. За родо-видовым названием следует, в случае необходимости, обозначение серотипа или штамма: Haemophihis influenzae d - Hind. Escherichia coli В - ЕсоВ.
3.Различные системы рестрикции-модификации, кодируемые одной и той же бактериальной клеткой, обозначаются римскими цифрами, например: HindI, HindII, HindIII.
4. Ферменты рестрикции-модификации в общем виде обозначаются как эндонуклеаза R или метилаза М с последующим определением названия системы, например: эндонуклеаза R * HindII или метилаза М * HindII.
5. Если система генетически локализована в геноме фага или на плазмиде, то после родо-видового названия указывается символ внехромосомного элемента: EcoРI, EcoKII. Штаммовая принадлежность в этих случаях указывается в скобках: Есо(К)РI.
Рестриктазы I класса, к которым относятся, к примеру, ферменты ЕсоК, EcoB, EcoPl и другие, атакуют ДНК в произвольных местах и образуют сплошной спектр рестриктов. Эти рестриктазы в генетической инженерии не исполь-зуются, поскольку с их помощью нельзя получить фрагменты ДНК строго детерминированных размеров.
Рестриктазы класса II. Системы рестрикции-модификации класса II состоят из отдельных белков рестрикционной эндонуклеазы и модификационной метилазы. Поэтому рестриктазы данного класса можно выделить в индиви-дуальном состоянии, свободном от метилазной активности, что в значительной мере упрощает их изучение и последующее использование для расщепления молекул ДНК.
Рестриктазы класса IIIимеют некоторое сходство с рестриктазами класса I. Нативный фермент состоит из двух различных субъединиц и бифункционален, т. е. обладает как рестриктазной, так и метилазной активностью. Рестриктазы класса III узнают несимметричные последовательности длиной 5-6 пн и расщепляют ДНК в стороне от участков узнавания на расстоянии 24-27 пн, образуя одноцепочечные 5'-концы длиной 2-3 нуклеотида. Для проявления эндонуклеазной активности требуются только АТР и ионы Mg2+, a SAM лишь стимулирует реакцию,причем расщепление ДНК не сопровождается гидролизом АТР. При действии ферментов данного класса in vitro не удается исчерпывающе гидролизовать ДНК. Причины этого пока не ясны.
-
Ферменты, используемые в ГИ: рестриктазы, ДНК-лигаза, нуклеаза Bal31.
Рестриктазы (рестрицирующие эндонуклеазы, эндонуклеазы рестрикции) — это ферменты, узнающие и атакующие определенные последовательности нуклеотидов в молекуле ДНК (сайты рестрикции). (Щелкунов Генетическая инженерия)
Рестриктазы узнают строго определенные последовательности нуклеотид:



Лигаз — фермент, катализирующий соединение двух молекул с образованием новой химической связи –лигирование.


Bal31


-
Ферменты, используемые в ги: днк-полимераза 1, концевая днк-трансфераза, поли-(а)-полимераза (все есть в книге)
-
Ферменты, используемые в ГИ: ревертаза, нуклеаза S1, РНК-аза Н.
-
Методы конструирования рекомбинантных молекул ДНК in vitro (коннекторный и рестриктазно-лигазный). Линкеры, адапторы.
-
Метод получения генов на основе м-РНК. Библиотеки кДНК.
При помощи ДНК-зонда
(одноцепочечная меченая молекула ДНК,
комплементарная какому-либо участку
м-РНК) находят информационную (матричную)
РНК. Практически все эукариотические
м-РНК содержат на своем 3' конце
последовательность, состоящую из
остатков аденина (поли А-последовательность),
которая присоединяется к м-РНК в
результате сплайсинга. Для начала
реакции синтеза ДНК-ревертазе нужна
затравка в виде небольшого двухцепочечного
отрезка. Эту функцию выполняют короткие
олигонуклеотиды из 18-20 тиминовых остатков
(поли д-Т), которые соединяются по принципу
комплементарности с поли А-последовательностью
и-РНК. В результате образуется гибридная
м-РНК - к-ДНК молекула, причем на конце
у нее будет синтезироваться короткий
отрезок двухцепочечной ДНК - шпилька.
Шпилька служит затравкой для синтеза
второй комплементарной цепи ДНК,
осуществляющегося уже ферментом
ДНК-полимеразой. Цепь м-РНК гидролизуется
РНК-азой, а шпилька (одноцепочечная ДНК)
- эндонуклеазой S1. В результате получится
двухцепочечная молекула к-ДНК,
соответствуюшая структурному гену, с
которого транскрибировалась исходная
молекула м-РНК. К полученной ДНК
присоединяют «липкие» концы для
встраивания в плазмиду и размножения
гена. Подобная схема была использована
для получения генов, кодирующих инсулин,
гормона роста, интерферона, альбумина,
иммуноглобулинов и др. белков, производство
которых уже налажено в промышленных
масштабах. Возможно и соединение
фрагментов ДНК с «тупыми» концами за
счет действия ДНК-лигазы, но эффективность
такого «сшивания» на порядок ниже.


-
Пцр, принципы метода.
Полимеразная цепная реакция (ПЦР) — экспериментальный молекулярно-
биологический метод, основанный на катализируемой ДНК-полимеразой реакции, и который позволяет амплифицировать (от английского amplify – многократно увеличивать, усиливать) малые концентрации определённых фрагментов ДНК биологическом материале в миллионы раз в течение нескольких часов.
Как проводится ПЦР
ПЦР можно условно разделить на два этапа – подготовительный и основной. Во время первого этапа идет подготовка реакционной смеси, иными словами, в одну пробирку скапываются все необходимые компоненты. Длится этот этап, в зависимости от количества пробирок и способа скапывания, обычно до часа. Во время второго этапа происходит собственно ПЦР, при этом пробирки с реакционной смесью помещают в специальный прибор и оставляют на несколько часов (обычно 3-5).
Подготовительный этап: какие компоненты нужны для ПЦР?
Реакционную смесь готовят в специально предназначенных для ПЦР тонкостенных пробирках типа Эппендорф объемом 200 микролитров (рис. 1). Для этого в пробирки последовательно добавляют все компоненты в рассчитанном объеме для получения необходимой финальной концентрации.
Поскольку, как уже упоминалось, ПЦР является модифицированной реакцией репликации, реакция невозможна без ДНК-матрицы – той ДНК, которая содержит необходимый для многократного копирования фрагмент. Матрицей может служить любая молекула ДНК любого живого организма, при этом концентрация может быть очень низкой – всего несколько копий ДНК. Конечно же, для построения новой цепи ДНК необходим фермент ДНК-зависимая ДНК- полимераза. При проведении ПЦР используют особую термостойкую версию фермента – Taq-полимеразу – произносится «так полимеразу». Фермент был получен из термофильной бактерии Thermus aquaticus. Первая буква рода и две первые буквы вида бактерии на
латинском языке определили название фермента - Taq. Почему так важна термостойкость фермента станет ясно чуть позже, когда будем говорить об основном этапе ПЦР. Ферменту для построения новой цепи необходимы «кирпичики» - предшественники нуклеотидов. Действительно, в реакционную смесь дезоксинуклеозиды трифосфаты, которые являются не только нуклеотидных звеньев в строящейся ДНК, но и источником энергии за счет своих макроэргических связей между остатками фосфатов. За счет этого АТФ в реакционную смесь не добавляют.
В естественных условиях в клетке репликация начинается в особых местах – точках начала репликации. При проведении ПЦР начало репликации определяют праймеры. Праймер – относительно короткий (20-40
нуклеотидов) одноцепочечный комплементарный одной из цепей ДНК-матрицы. Праймер служит затравкой для ДНК- полимеразы подобно РНК-затравке в естественном процессе репликации. Для ПЦР нужно два
праймера – прямой (на английском - forward) и обратный (на английском - reverse). Прямой праймер «садится» на транскрибируемую (матричную) цепь в начале фрагмента и обеспечивает синтез дочерней цепи от начала к концу. Обратный праймер соединяется с нетранскрибируемой цепью ДНК в конце фрагмента и обеспечивает синтез другой дочерней цепи в направлении от конца к началу (рис. 2).

Рисунок 2 Схематическое изображение мест присоединения праймеров. Жирным шрифтом обозначен фрагмент, число копий которого необходимо многократно увеличить.
Стрелками обозначены направления, в которых будет идти синтез новых цепей. 20-ти нуклеотидные праймеры приведены в серых прямоугольниках. Обратите внимание, что их последовательность строго комплементарна цепям ДНК-матрицы.
Фермент ДНК-полимераза для функциональной активности требует наличие в реакционной среде ионов магния. Поэтому ионы магния, обычно в составе MgCl2, обязательно добавляют в пробирку. ДНК-полимераза, подобно многим другим ферментам требует для оптимальной активности определенного уровня кислотности. Поэтому обязательным компонентом реакционной смеси является специальный ПЦР-буфер, который обеспечивает поддержание оптимального pH. Наконец, последним необходимым компонентом реакции ПЦР является вода. С одной стороны, она является средой для протекания реакций, с другой стороны, меняя ее объем, добиваются одинакового объема реакционной смеси и нужной концентрации
компонентов. Все компоненты с кратким перечислением их функций приведены в таблице 1

Основной этап: что происходит в пробирке?
После того как смесь готова, начинается основной этап ПЦР. Основной этап состоит из 20 – 40 циклов. Каждый цикл протекает по одной и той же схеме и состоит из трех стадий – денатурация, отжиг (или гибридизация) праймеров, элонгация. Каждая стадия протекает при строго определенной температуре (рис. 3). Для последовательного создания и поддержания необходимого температурного режима необходимо специальное оборудование - амплификатор (рис. 4). Разберемся подробнее с каждой из стадий.

Рисунок 3 Схематическое изображение температурного режима в течение первых двух циклов ПЦР.

Рисунок 4 Амплификатор для проведения ПЦР.
Первая стадия называется денатурация или плавление. Во время этой стадии происходит разрушение водородных связей в ДНК-матрице за счет кратковременного нагревания пробирки со смесью до 94-98 °С (рис. 5А). При этом ДНК-матрица из двуцепочечной превращается в одноцепочечную, что делает возможным присоединение праймеров к комплементарным
участкам. Именно во время стадии денатурации крайне важна термостабильность фермента Taq-полимеразы. Если бы использовалась термочувствительная ДНК-полимераза, то она, будучи по химической природе белком, при столь высокой температуре подвергалась бы необратимой денатурации. Для присоединения праймеров необходимо снизить температуру в среднем до 50-60 °С. Температура рассчитывается теоретически в зависимости от длины и нуклеотидного состава праймеров, а потом оптимизируется экспериментально. Процесс присоединения праймеров по краям нужного фрагмента называется отжигом или гибридизацией праймеров (рис. 5Б).
Подбор оптимальной температуры для отжига праймеров очень важен. Если температура ниже оптимальной, то праймеры будут присоединяться в местах, которые не полностью им комплементарны, что приведет к амплификации неспецифических участков ДНК. В случае более высокой температуры праймеры, наоборот, с трудом будут присоединяться к ДНК-матрице или не будут присоединяться вовсе. После того, как праймеры присоединились к комплементарным участкам в начале и конце фрагмента, температуру поднимают до 72 °С, поскольку эта температура оптимальна для функционирования Taq-полимеразы. Фермент начинает удлинять праймеры в обоих направлениях. Этот этап называется элонгацией (рис. 5В). Длительность его определяется длиной фрагмента, который необходимо амплифицировать. На каждую тысячу пар нуклеотидов отводится в среднем 1 минута.

Рисунок 5 Схематическое изображение трех стадий Прямоугольниками выделены фрагменты ДНК, которые необходимо амплифицировать. Точками обозначены водородные связи между комплементарными участками. Стрелками обозначены праймеры и направления синтеза новых цепей ДНК. Штриховой линией обозначены цепи, которые синтезированы на этапе элонгации.


Рисунок 6 Схематическое изображение первых трех циклов ПЦР.
Первые 3цикла ПЦР: Для удобства возьмем изначально одну копию ДНК в качестве матрицы (А). К концу первого цикла нужный фрагмент будет удвоен (Б и В), при этом одна из цепей каждого продукта будет идентична исходной матрице (обозначена серым цветом), а другая будет вновь синтезированная (обозначена черным цветом). Важно отметить, что продукты первого цикла не полностью идентичны исходной матрице, поскольку удваивается не вся ДНК, а только необходимый фрагмент.
Далее продукты первого цикла – Б и В – становятся матрицами для второго цикла. Поскольку они при денатурации распадутся на четыре одноцепочечные молекулы ДНК, каждая из которых станет местом присоединения одного из праймеров, в конце второго цикла образуется четыре продукта – Г, Д, Е и Ж. В третьем цикле матрицами будут служить продукты второго цикла, которые при денатурации распадутся на 8 одноцепочечных молекул. Это означает, что в конце третьего цикла в пробирке будет 8 двуцепочечных копий необходимого фрагмента. Обратите внимание, что доля исходных цепей (обозначена серым цветом) в конце первого цикла составляет 50%, в конце второго цикла – 25%, а в конце третьего только 12,5%. Также отметьте, что только в конце третьего цикла впервые появляются продукты без одноцепочечных «хвостов» - И и О. С каждым последующим циклом доля таких продуктов будет возрастать, а доля исходных цепей уменьшаться.
Достоинства метода ПЦР
1. Высокая чувствительность исследования
Чувствительность метода такова, что амплифицировать в ПЦР и выявить целевую последовательность можно даже в том случае, если она встречается однажды в образце из 105 клеток.
2. Специфичность анализа
ПЦР позволяет выявлять ДНК конкретного инфекционного агента в присутствии ДНК других микроорганизмов и ДНК организма-хозяина, а также проводить генотипирование. Специфически подбирая компоненты реакции (праймеры), Вы можете одновременно выявлять ДНК близкородственных микроорганизмов.
3. Универсальность метода ПЦР
Дело в том, что для ПЦР-диагностики инфекционных заболеваний, либо наследственных заболеваний человека можно использовать одно и то же оборудование, следовать универсальным процедурам подготовки образцов (проб) и постановки анализа, а также однотипные наборы реактивов.
4. Экономия времени
Важное преимущество ПЦР – отсутствие стадий культуральной микробиологической работы. Подготовка образцов, проведение реакции и анализ результатов максимально облегчен и во многом автоматизирован. Благодаря этому, время получения результата может сокращаться до 4-5 часов.
5. Эффективность метода ПЦР
ПЦР помогает избежать известных сложностей, возникающих при выращивании труднокультивируемых, некультивируемых или персистирующих форм микроорганизмов для диагностики латентных и хронических инфекций. Эффективен метод ПЦР и при скрининге возбудителей с высокой антигенной изменчивостью, а также внутриклеточных паразитов.
6. Широта исследуемого клинического материала
В качестве образца при полимеразной цепной реакции может быть использован не только биологический материал от больного, но также и многие другие субстраты, в которых могут быть идентифицированы молекулы ДНК с высокой чувствительностью, например, вода, почва, продукты питания, микроорганизмы, смывы и многое другое.
Все перечисленные выше достоинства этого уникального метода - высокая чувствительность и специфичность, идентификация инфекционного агента и проведение генотипирования любого гена человека, высокая эффективность и экономия времени, универсальность приборной базы – позволяют широко применять сегодня метод ПЦР в клинической диагностике, медицинской практике, научных исследованиях, контроле качества и многих других областях.
