
- •1)Химия пәні мен мақсаттары, міндеттері. Химияның жаратылыстану ғылымдарының арасындағы орны, ғылымдардың химия пәнімен өзара арақатынасы.Химия және экология.
- •3) Ертінділер. Ертіндінің классификациясы (жүйелері). Еріткіш және еритін зат. Нағыз ертінділердің негізгі қасиеттері. Қаныққан, аса қаныққан және қанықпаған ертінділер.
- •4) Эквиваленттер заңы. Fe2(so4)3-тің эквивалентін табыңыз.
- •5)Химияның негізгі түсініктері мен заңдары. Химиялық таңбалар. Атом-молекулалық ілім. Атом, молекула, элемент, зат түсінігі
- •6) Егер CuSo4-тен тоқ 3а күшпен 1,5 минутта өтсе, неше грамм Cu түзіледі?
- •7) Ертінді құрамын көрсету тәсілдері (заттың ертіндідегі массалық үлесі, молярлық концентрация, нормальді концентрация).
- •8) Ертінділердің қасиеттері. Осмос қысымы. Вант-Гофф заңы.
- •9)Стехиометрлік заңдар: массаның сақталу заңы, құрам тұрақтылық заңы, эквиваленттілік заңы.
- •10)Электронды баланс, жартылай-иондық реакция әдістері бойынша келтірілген реакциядағы коэффиценттерді табыңыз:
- •11. Бейэлектролит ерітінділерінің қату температурасының төмендеуі және қайнау температурасының жоғарылауы. Раульдың 2-ші заңы.
- •13. Электролиттер және бейэлектролиттер. С. Аррениустың электролиттік диссоциация теориясы
- •14. Химиялық эквивалент. Қышқылдардың және тұздардың эквиваленттерін табыңыз. HCl, h2so4, h3po3, Na3po4
- •22) . Қышқылдар және олардың классификациясы. Қышқылдардың алынуы химиялық қасиеттері.
- •23) Электрохимия негіздері. Электродтық потенциалдар.
- •24) Na2co3 тұзының гидролиз реакциясын жазыңыз. РН қалай өзгереді?
- •25)Термохимиялық теңдеулер
- •32)Метафосфор қышқылының структуралық формуласын жазыңыз.
- •33) Фарадейдің I.II-ші заңдары.Металдар коррозиясы. Коррозиядан қорғау әдістері.
- •35) Вант-Гофф ережесі. Активті энергия түсінігі, оның химиялық реакциялар жылдамдығына әсері.
- •36) Егер элементтердің электрондық формулалары: а) 2s2 2p3; б) 3s2 3p4; в) 3d10 4s2 болса, онда осы элементтер үшін қалыпты және қозған күйдің электрондық формулаларын жазыңыз
- •37)Химиялық тепе-теңдік. Қайтымды және қайтымсыз реакциялар. Химиялық тепе-теңдік күйі. Ле-Шателье принципі.
- •38. Негіздік немесе гидроксотұздар. Мыстың гидроксосульфатының структуралық(құрылымдық) формуласын жазыңыз. Екінші аты қалай?
- •39)Атом құрылымы және д.И.Менделеевтің периодтық заңы.
24) Na2co3 тұзының гидролиз реакциясын жазыңыз. РН қалай өзгереді?
 тұзының
гидролизі
тұзының
гидролизі
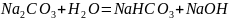

pH>7
25)Термохимиялық теңдеулер
Жану реакциялар дегеніміз не? (Реакция кезінде жылу бөлініп, жарық шығады)
Жылу бөле жүретін реакция – экзотермиялық реакция деп аталады.
Жылу сіңіре жүретін реакция - эндотермиялық реакция деп аталады.
Жылу мөлшері джоуль Дж немесе кДж деп белгіленеді.
С+О2= СО2+G (+G жылу бөліну)
N2+O2=2NO2–G(-Gжылусәңірілу)
Реакцияның жылу эффекті көрсетілген химиялық реакциялар – термохимиялық теңдеулер деп аталады.
С+О2= СО2+ 402,24 кДж 2Н2О = Н2 + О2 – 571,6 кДж
Термохимиялық теңдеулер бойынша есептеулер жүргізу.
Есеп №1. 12г сутегі оттегі де жанғанда қанша мөлшер де жылу бөлінеді,егер сутегінің жануының термохимиялық теңдеулер мынаған тең болса:
12г х
2Н2 + О2 = 2Н2О + 571,6кДж
4г
Химиялық теңдеу бойынша 4 г сутегі жаңғанда 571,6 кДж жылу бөлінеді. Пропорция әдісі.
12г------------------------------хкДж
4г--------------------------571,6кДж
х=12•571,6/4=1714,8кДж
26) 1 л ертіндіде 49 г Н2SO4 бар. (M(H2SO4) = 98 г/моль). Ертіндінің нормальдығы мен молярлығын табыңыз.
C=m/(M*V)=49/(98*1)=0.5
N=m/(MЭ*V)=49/(49*1)=1
27) Тотығу-тотықсыздану реакциялары. Тотықсыздандырғыш мен тотықтырғыш.



28) Судың иондық көбейткіші. Сутектік көрсеткіш. [H+]=10-4 г-ион/л. рOН-ты табыңыз.

29)Химиялық кинетика. Химиялық реакциялар жылдамдығы. Химиялық реакциялар жылдамдығына әсер ететін факторлар.


30)Кальций гидроксидінің электролиттік диссоциациясы, неше сатыда жүреді?
Ca(ОН)2![]() Са(ОН)+ +
OH— (Бірінші
саты)
Са(ОН)+ +
OH— (Бірінші
саты)
Ca(OH)+ Ca2++OH— (Екінші саты)
31)Әрекеттесуші массалар заңы. Жылдамдық тұрақтысының физикалық мағынасы.
Реакцияның жылдамдығына әрекеттесуші заттардың концентрациясының әсерін зерттеген Норвегия ғалымдары Гульдберг және Вааге 1867-жылы мынадай қорытындығыға келген:
Химиялық реакцияның жылдамдығы реакцияласушы заттардың концентрацияларының көбейтіндісіне тура пропорцианал. Мұны әрекеттесуші массалар заңы деп атайды. бұл заттың математикалық теңдеуін жазу үшін, реакцияны жалпы түрде былай жазайық:
A+B=C
A және B затының концентрациясын [A] және [B] , реакциясының жылдамдығын деп белгілесек болады:
v=k*[A]*[B]
мұнда k-пропорцианалдық коэффициент.
32)Метафосфор қышқылының структуралық формуласын жазыңыз.
HPO3

33) Фарадейдің I.II-ші заңдары.Металдар коррозиясы. Коррозиядан қорғау әдістері.
Фарадей заңдары — электролиздер арқылы электр тогы өткенде электродтарда бөлінетін не ыдырайтын заттардың мөлшерін (массасын) анықтайтын электролиз процесінің негізгі заңдары. Ол заңдарды 1833 — 34 ж. ағылшын ғалымы М.Фарадей ашқан. Фарадейдің 1-заңы былай тұжырымдалады: Электролит арқылы ток өткенде электродта бөлініп шыққан заттың массасы (т) ток күшіне (Қ) және ток жүрген уақытқа (t) пропорционал, яғни т=kҚt, мүндағы k — электролиттегі заттың электрхимиялық эквиваленті деп аталатын пропорционалдық коэффициент Фарадейдің 2-заңы электрхим. эквиваленттің шамасын анықтайды: k=1M/Fn=A/F, мұндағы п — ионның заряды (валенттігі), A=kFz, электролиттегі заттың химиялық эквиваленті, яғни элементтің электрхимиялық эквиваленті оның химиялық эквивалентіне пропорционал. Фарадей заңының математикалық өрнегі электролиз кезінде бөлінетін заттың массасын, электрхимиялық және химиялық эквиваленттерін дәл анықтау үшін пайдаланылады.
Коррозия дегеніміз — металдардың және олардың құймаларының қоршаған орта әсерінен иондануы, бұзылуы, нәтижесінде металдық қасиетінің жойылуы. Яғни, коррозия кезінде металдар тотығып ион күйіне көшеді.
Ме0 – ne → Me
Химиялық коррозия дегеніміз металдың сыртқы ортамен химилық әрекеттесуінен бүлінуі.
Электрохимиялық коррозия дегеніміз сыртқы орта әсерінен гальваникалық түзілу нәтижесінде металдың бүлінуі.
Коррозияданқорғау:
1) Қаптау (металдық, бейметалдық)
2) Жемірілуге қарсы құймалар
3) Сүйеніш (протектор) қорғаныш.
4) Орта құрамын өзгерту (ингибитор) деаэрация
5) Металдарды жаңа конструкциямен ауыстыру.
34) 100 мл ерітіндіде 3,4 г AgNO3 бар. (MAgNO3= 170г/моль). Ертіндінің нормальділігін табыңыз.
N=m/(Mэ*V)=49/(49*1)=1
