
- •1)Химия пәні мен мақсаттары, міндеттері. Химияның жаратылыстану ғылымдарының арасындағы орны, ғылымдардың химия пәнімен өзара арақатынасы.Химия және экология.
- •3) Ертінділер. Ертіндінің классификациясы (жүйелері). Еріткіш және еритін зат. Нағыз ертінділердің негізгі қасиеттері. Қаныққан, аса қаныққан және қанықпаған ертінділер.
- •4) Эквиваленттер заңы. Fe2(so4)3-тің эквивалентін табыңыз.
- •5)Химияның негізгі түсініктері мен заңдары. Химиялық таңбалар. Атом-молекулалық ілім. Атом, молекула, элемент, зат түсінігі
- •6) Егер CuSo4-тен тоқ 3а күшпен 1,5 минутта өтсе, неше грамм Cu түзіледі?
- •7) Ертінді құрамын көрсету тәсілдері (заттың ертіндідегі массалық үлесі, молярлық концентрация, нормальді концентрация).
- •8) Ертінділердің қасиеттері. Осмос қысымы. Вант-Гофф заңы.
- •9)Стехиометрлік заңдар: массаның сақталу заңы, құрам тұрақтылық заңы, эквиваленттілік заңы.
- •10)Электронды баланс, жартылай-иондық реакция әдістері бойынша келтірілген реакциядағы коэффиценттерді табыңыз:
- •11. Бейэлектролит ерітінділерінің қату температурасының төмендеуі және қайнау температурасының жоғарылауы. Раульдың 2-ші заңы.
- •13. Электролиттер және бейэлектролиттер. С. Аррениустың электролиттік диссоциация теориясы
- •14. Химиялық эквивалент. Қышқылдардың және тұздардың эквиваленттерін табыңыз. HCl, h2so4, h3po3, Na3po4
- •22) . Қышқылдар және олардың классификациясы. Қышқылдардың алынуы химиялық қасиеттері.
- •23) Электрохимия негіздері. Электродтық потенциалдар.
- •24) Na2co3 тұзының гидролиз реакциясын жазыңыз. РН қалай өзгереді?
- •25)Термохимиялық теңдеулер
- •32)Метафосфор қышқылының структуралық формуласын жазыңыз.
- •33) Фарадейдің I.II-ші заңдары.Металдар коррозиясы. Коррозиядан қорғау әдістері.
- •35) Вант-Гофф ережесі. Активті энергия түсінігі, оның химиялық реакциялар жылдамдығына әсері.
- •36) Егер элементтердің электрондық формулалары: а) 2s2 2p3; б) 3s2 3p4; в) 3d10 4s2 болса, онда осы элементтер үшін қалыпты және қозған күйдің электрондық формулаларын жазыңыз
- •37)Химиялық тепе-теңдік. Қайтымды және қайтымсыз реакциялар. Химиялық тепе-теңдік күйі. Ле-Шателье принципі.
- •38. Негіздік немесе гидроксотұздар. Мыстың гидроксосульфатының структуралық(құрылымдық) формуласын жазыңыз. Екінші аты қалай?
- •39)Атом құрылымы және д.И.Менделеевтің периодтық заңы.
6) Егер CuSo4-тен тоқ 3а күшпен 1,5 минутта өтсе, неше грамм Cu түзіледі?
Cu2+ + 2e = Cu m = (M*I*t)/(n*F) = (64*3*1,5*60)/(2*96500) = 0.8953 г.
7) Ертінді құрамын көрсету тәсілдері (заттың ертіндідегі массалық үлесі, молярлық концентрация, нормальді концентрация).
Ерітінділер дегеніміз – екі немесе одан да көп компонентерден тұратын, құрамы өзгермелі гомогенді(біртекті) жүйе.
Ерітінділердің маңызды түрі – сұйық ерітінділер.
Ерітінділер еріген заттан және еріткіштен тұрады. Ерітінді құрамы еріген затпен еріткіш мөлшерімен анықталады. Ерітінді концентрациясын сипаттау үшін жиі қолданатын бірнеше әдістер бар.
1)Еріген заттың массалық үлесі (В) дегеніміз еріген заттың массасының m(B) ерітінді массасына mжалпы қатынасы:
(В) = m(В)/mжалпы немесе (В) = 100m(В)/mжалпы (%);
2) Молярлық концентрация с(В) дегеніміз 1 л ерітіндідегі еріген заттың мөлшері:
с(В) = n(В)/Vер-ді, (моль/л);
3) Моляльдік концентрация дегеніміз 1 кг еріткіштегі еріген заттың мөлшері:
b(В) = n(В)/mер-ш, (моль/кг);
4) Нормальдік концентрация дегеніміз 1 л ерітіндідегі еріген заттың эквиваленттік зат мөлшері:
с(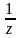 В)
= n(
В)/Vерітінді,
(моль/л);
В)
= n(
В)/Vерітінді,
(моль/л);
мұндағы, n( В)-эквиваленттік зат мөлшері.
5) Титр дегеніміз 1 мл ерітіндідегі еріген заттың грамы:
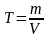 ,
(г/мл)
,
(г/мл)
Мысалы: 10 % 200 г натрий сульфатының ерітіндісін дайындау үшін:
100 г ерітіндіде 10 г Na2SO4
200 г ерітіндіде m г Na2SO4
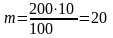 г. Судың массасы 200 - 20 = 180 г.
г. Судың массасы 200 - 20 = 180 г.
Таразыда 10 г Na2SO4 өлшеп, 200 мл колбаға салып, белгі қойылған жерге дейін суды араластыра отырып, құйыңдар.
Кестеден 10 % Na2SO4 ерітіндісінің тығыздығын табамыз:
ол 1,091 г/см3 тең. Ерітіндінің массасы: m = V p = 1000 1,091 = 1091 г
100 г ерітіндіде 10 г Na2SO4
1091 г ерітіндіде m г Na2SO4
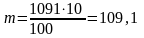 г.
г.

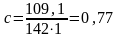 моль/л
моль/л
8) Ертінділердің қасиеттері. Осмос қысымы. Вант-Гофф заңы.
Ерітінділердің қасиеттері: осмос, ерітінділер буының қысымы, ерітінділердің қату (кристалдану) және қайнау температулары
Осмос қысымдары бірдей ерітінділер изотонды ерітінділер деп аталады. Басқа ерітіндіге қарағанда осмос қысымы жоғары болса гипертонды, төмен болса гипотонды ерітінділер деп аталады.
Ерітіндінің осмос қысымы(өлшемі – атм.), сол еріген зат газ күйінде болып, осы температурада, ерітіндінің көлеміндей көлем алып тұрғандағы туғызытын қысымына тең (Вант-Гофф заңы).Осмос қысымын П немесе p деп белгілейді. Осмос қысымы еріген зат табиғатына тәуелсіз, ал ерітіндінің концентрациясына және температураға тура пропорционал екендігін Голландия ғалымы Вант-Гофф 1887 жылы (газдарға қолданылған Бойль-Мариот пен Гей-Люссак заңдарына ұқсас екендігін анықтады) мына формуламен есептеуге болатынын тапты: p = cRT, мұндағы с – ерітіндінің молярлы концентрациясы, моль/л; R – константа, сандық мәні газдар тұрақтысына тең, 0,082л-атом/град, Т – абсолют температура.
1 моль затты 1000г еріткіште еріткенде қату температурасының төмендеуі (қайнау температурасының жоғарылауы) әрбір еріткіштің өзіне тән тұрақты шама. Оны еріткіштің криоскопиялық және эбуллиоскопиялық константалары деп атайды (Кк және Кэ), яғни олар еріткіш табиғатына тәуелді (байланысты ). Мысалы, су үшін Кк = 1,86 және Кэ = 0,516град×моль-1×кг. Рауль заңының математикалық өрнегі: ▲t = K×C – мұндағы К криоскопиялық және эбуллиоскопиялық константалар, С моляльды концентрация, моль/кг, ▲t – қату температурасының төмендеуі не қайнау температурасының жоғарылауы. Кэ және Кк – концентрациясы 1 моль/кг болатын ерітінділердің қайнау температурасының көтерілуіне және қату температурасының төмендеуіне тең шама. Егер концентрациядағы моль орнына m/M қойылса, онда ▲t = K×C былай жазылады ▲t = K×m/M, одан М = K×m/▲t – еріген заттың молекулалық массасын табуға болады. Заттардың салыстырмалы молекулалық массаларын ерітінділердің қату температуларының төмендеуі және қайнау температураларының жоғарылауы арқылы анықтау әдісі – криоскопиялық және эбуллиоскопиялық деп аталады. Рауль заңдарына, Вант-Гофф заңына концентрленген ерітінділер және электролит ерітінділері бағынбайды.
