
- •1)Химия пәні мен мақсаттары, міндеттері. Химияның жаратылыстану ғылымдарының арасындағы орны, ғылымдардың химия пәнімен өзара арақатынасы.Химия және экология.
- •3) Ертінділер. Ертіндінің классификациясы (жүйелері). Еріткіш және еритін зат. Нағыз ертінділердің негізгі қасиеттері. Қаныққан, аса қаныққан және қанықпаған ертінділер.
- •4) Эквиваленттер заңы. Fe2(so4)3-тің эквивалентін табыңыз.
- •5)Химияның негізгі түсініктері мен заңдары. Химиялық таңбалар. Атом-молекулалық ілім. Атом, молекула, элемент, зат түсінігі
- •6) Егер CuSo4-тен тоқ 3а күшпен 1,5 минутта өтсе, неше грамм Cu түзіледі?
- •7) Ертінді құрамын көрсету тәсілдері (заттың ертіндідегі массалық үлесі, молярлық концентрация, нормальді концентрация).
- •8) Ертінділердің қасиеттері. Осмос қысымы. Вант-Гофф заңы.
- •9)Стехиометрлік заңдар: массаның сақталу заңы, құрам тұрақтылық заңы, эквиваленттілік заңы.
- •10)Электронды баланс, жартылай-иондық реакция әдістері бойынша келтірілген реакциядағы коэффиценттерді табыңыз:
- •11. Бейэлектролит ерітінділерінің қату температурасының төмендеуі және қайнау температурасының жоғарылауы. Раульдың 2-ші заңы.
- •13. Электролиттер және бейэлектролиттер. С. Аррениустың электролиттік диссоциация теориясы
- •14. Химиялық эквивалент. Қышқылдардың және тұздардың эквиваленттерін табыңыз. HCl, h2so4, h3po3, Na3po4
- •22) . Қышқылдар және олардың классификациясы. Қышқылдардың алынуы химиялық қасиеттері.
- •23) Электрохимия негіздері. Электродтық потенциалдар.
- •24) Na2co3 тұзының гидролиз реакциясын жазыңыз. РН қалай өзгереді?
- •25)Термохимиялық теңдеулер
- •32)Метафосфор қышқылының структуралық формуласын жазыңыз.
- •33) Фарадейдің I.II-ші заңдары.Металдар коррозиясы. Коррозиядан қорғау әдістері.
- •35) Вант-Гофф ережесі. Активті энергия түсінігі, оның химиялық реакциялар жылдамдығына әсері.
- •36) Егер элементтердің электрондық формулалары: а) 2s2 2p3; б) 3s2 3p4; в) 3d10 4s2 болса, онда осы элементтер үшін қалыпты және қозған күйдің электрондық формулаларын жазыңыз
- •37)Химиялық тепе-теңдік. Қайтымды және қайтымсыз реакциялар. Химиялық тепе-теңдік күйі. Ле-Шателье принципі.
- •38. Негіздік немесе гидроксотұздар. Мыстың гидроксосульфатының структуралық(құрылымдық) формуласын жазыңыз. Екінші аты қалай?
- •39)Атом құрылымы және д.И.Менделеевтің периодтық заңы.
1)Химия пәні мен мақсаттары, міндеттері. Химияның жаратылыстану ғылымдарының арасындағы орны, ғылымдардың химия пәнімен өзара арақатынасы.Химия және экология.
1.Химия – заттардың бірі-біріне айналып өзгеруін зерттейтін ғылым.
Мақсаттары мен міндеттері:
1)заттардың қасиеттерін зерттеу
2)заттарды адам игілігіне жұмсау
3)табиғатта кездеспейтін жаңа заттарды синтездеп шығару
Химия физика және басқа да жаратылыстану ғылымдарымен тығыз байланысты. Химия мен биология арасынан шыққан биохимия , химия мен геология арасынан геохимия, космохимия , гидрохимия салалары, өнеркәсіп пен химияның барлық салаларында талдау әдістері үшін қолданылатын аналитикалық химия қалыптасты. Кейбір химиялық мәліметтер ерте заманнан белгілі болған.
Химия мен экология өте тығыз байланысты. Химия арқылы экологияны қорғауға да, зиян келтіруге де болады.
2) Аммиак алу реакциясының тепе-теңдік константасы.
N2(г) + 3H2(г) ↔ 2NH3(г)
K=[(NH3)2]/[N2][(H2)3]
3) Ертінділер. Ертіндінің классификациясы (жүйелері). Еріткіш және еритін зат. Нағыз ертінділердің негізгі қасиеттері. Қаныққан, аса қаныққан және қанықпаған ертінділер.
Ерітінді – ең кемі екі компоненттен тұратын біртекті жүйе.
Еріткіш – ішінде еріген зат молекула, не тіпті ион түрінде біркелкі болып араласатын біркелкі орта.
Еріген зат – еритін зат пен сұйықтықтың қоысылысы
Қанттың судағы ерітіндісі: (12C * 11 H2O) немесе C12H22O11
Ерітінділердегі еріген заттың сандық сипаттамасын беру үшін концентрация ұғымы қолданылады.
Еріген заттың массалық үлесі дегеніміз еріген заттың массасының ерітінді массасына қатынасы:
W = m1/m2
Молярлік концентрация дегеніміз 1 л ерітіндідегі еріген затттың мөлшері:
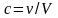
Моляльдік концентрация дегеніміз 1 кг еріткіштегі еріген заттың мөлшері:
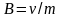
Нормальдік
концентрация
дегеніміз 1 л ерітіндідегі еріген заттың
эквиваленттік зат мөлшері:

Cэ= vэ/V
Мұндағы, vэ-эквиваленттік зат мөлшері
Титр дегеніміз 1 мл ерітіндідегі еріген заттың грамы.
Шын немесе нағыз ерітінді деп – ерітіндідегі бөлшектің радиусы –10-8 − 10-7см аралығында болады.
Қанықпаған ерітінді – еріген заттың жаңа мөлшерін әлі еріте алатын
ерітінді.
Қанық ерітінді – белгілі бір температурада затты одан әрі еріте алмайтын ерітінді.
Аса қанық ерітінді – сол температурадағы ерігіштігіне сәйкес еруге тиісті мөлшерден артық затты еріген күйде ұстай алатын ерітінді. Аса қанық ерітінді тұрақсыз, еріген заттың аз мөлшерін ғана ерітіндіге салса, артық еріген зат тез кристалданады.F
4) Эквиваленттер заңы. Fe2(so4)3-тің эквивалентін табыңыз.
Эквиваленттер заңы - әрекеттесетін заттардың массасы олардың эквивалент массаларына пропорционал.
Эквивалент – екі элементтің немесе екі заттың бір – бірімен қалдықсыз әрекеттесетін тең мөлшерін көрсетеді.
Fe2(SO4)3 эквиваленттік массасы:
Mr(Fe2(SO4)3)= 55,8x2+(32+16x4)х3=399,6
Валенттілік: 2х3=6
Эквиваленттік массасы= молярлық масса / валенттілік
399,6/6=66,6 г/моль
