
- •Современное состояние энергетики рб и пути ее развития. Предмет и метод термодинамики.
- •Термодинамические параметры состояния. Термодинамическая система. Термодинамическая поверхность. Термодинамический процесс. Виды термодинамического процесса.
- •Эквивалентность теплоты и работы. Первый закон термодинамики. Уравнение первого закона термодинамики.
- •Работа расширения. Круговой процесс.
- •Внутренняя энергия и энтальпия как функции состояния. Удельная внутренняя энергия.
- •Идеальный газ. Основные законы идеального газа (Гей-Люссака, Шарля, Бойля-Мариотта). Уравнение состояния идеального газа. Уравнение состояния идеального газа для одного киломоля.
- •Закон а. Авогадро (2 следствия из закона). Понятие о моле и киломоле.
- •Теплоемкость (мольная, массовая, объемная, средняя, истинная). Теплоемкость идеального газа. Ср и Сv теплоёмкости. Связь между Ср и Сv.
- •Изобарный, изохорный, изотермический процессы изменения состояния идеального газа.
- •Адиабатный и политропный процессы изменения состояния идеального газа.
- •Второй закон термодинамики и его значение. Основная формулировка. Циклы. Тепловой двигатель. Рабочее тело. Понятие термического кпд. Источники теплоты
- •Цикл Саади Карно. Термический кпд цикла Карно.
- •Энтропия, как функция состояния. Изменение энтропии в необратимых процессах
- •Цикл Отто.
- •Цикл Дизеля.
- •Цикл Тринклера
- •Водяной пар. Парообразование. Испарение. Кипение. Конденсация. Конденсат. Сублимация. Десублимация. Уравнение состояния реальных газов.
- •Насыщенный пар. Сухой насыщенный пар. Влажный насыщенный пар. Степень сухости пара. Степень влажности пара. Перегретый пар.
- •Процесс парообразования на
- •Is (hs)-диаграмма состояния воды и водяного пара:
- •Основные параметры жидкости и сухого насыщенного пара.
- •Основные параметры влажного насыщенного пара. Основные параметры перегретого пара.
- •Термодинамические процессы изменения состояния водяного пара.
- •Изохорное изменение состояния пара
- •Изобарное изменение состояния пара
- •Изотермическое изменение состояния пара
- •Адиабатное изменение состояния водяного пара
- •Цикл Ренкина.
- •Цикл Ренкина в Ts-диаграмме
- •Цикл пту с промежуточным перегревом пара.
- •Регенеративный цикл пту.
- •Теплофикационный цикл пту.
- •Парогазовый цикл.
- •Схемы тепловых электрических станций.
- •Тепловая схема тэс
- •Атомные станции.
- •Тепловая схема аэс
- •Температурное поле. Температурный градиент. Условия однозначности.
- •Тепловой поток. Закон теплопроводности Фурье. Коэффициент теплопроводности.
-
Адиабатный и политропный процессы изменения состояния идеального газа.
Адиабатический процесс (изоэнтропийный):
Адиабатический процесс – термодинамический процесс, происходящий без теплообмена с окружающей средой.
Для того чтобы осуществить такой процесс, следует либо теплоизолировать газ, т. е. поместить его в адиабатную оболочку, либо провести процесс настолько быстро, чтобы изменение температуры газа, обусловленное его теплообменом с окружающей средой, было пренебрежимо мало по сравнению с изменением температуры, вызванным расширением или сжатием газа. Как правило, это возможно, ибо теплообмен происходит значительно медленнее, чем сжатие или расширение газа.
![]()
Это и есть уравнения адиабаты идеального газа при постоянном отношении теплоемкостей (k = const). Величина
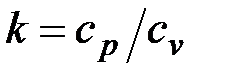
называется показателем адиабаты. Подставив cp = cv-R, получим k. Согласно классической кинетической теории теплоемкость газов не зависит от температуры, поэтому можно считать, что величина k также не зависит от температуры и определяется числом степеней свободы молекулы. Для одноатомного газа k =1,66, для двухатомного k =1,4, для трех- и многоатомных газов k = l,33.

Изображение адиабатного процесса в р, v- и Т, s-координатах
Политропический процесс. Процесс, при котором теплоёмкость газа остаётся постоянной. Политропический процесс – общий случай всех перечисленных выше процессов.

Показатель
политропы n может
принимать любое численное значение
в пределах от ![]() ,
но для данного процесса он является
величиной постоянной.
,
но для данного процесса он является
величиной постоянной.

-
Второй закон термодинамики и его значение. Основная формулировка. Циклы. Тепловой двигатель. Рабочее тело. Понятие термического кпд. Источники теплоты
Первый закон термодинамики, как уже сказано, характеризует процессы превращения энергии с к о л и ч е с т в е н н о й стороны. Второй закон термодинамики характеризует к а ч е с т в е н н у ю сторону этих процессов.
Одна из формулировок второго закона термодинамики: теплота не может самопроизвольно переходить от менее нагретого тела к более нагретому.
Работу нельзя получать за счет энергии тел, находящихся в термодинамическом равновесии. В этом основной смысл второго закона термодинамики.
Популярная формулировка второго закона термодинамики: невозможен вечный двигатель второго рода, т.е. невозможно создать циклически действующую машину, единственным результатом которой было бы совершение механической работы за счет охлаждения теплового резервуара.
Обратимый процесс – термодинамический процесс, после которого система и взаимодействующие с ней системы (окружающая среда) могут возвратиться в начальное состояние без того, чтобы в системе и окружающей среде возникали какие-либо остаточные изменения.
Необратимый процесс – термодинамический процесс, после которого система и взаимодействующие с ней системы (окружающая среда) не могут возвратиться в начальное состояние без возникновения остаточных изменений в системе или окружающей среде (ОС).
Тепловой двигатель – устройство непрерывного действия, получающее энергию в форме теплоты, которая затем передается окружению в форме работы и, в обязательном порядке, в форме теплоты. Тепловой двигатель содержит три основные части: нагреватель, рабочее тело, холодильник. Механическая работа в тепловых двигателях производится в процессе расширения некоторого вещества, которое называется рабочим телом. В качестве рабочего тела обычно используются газообразные вещества (пары бензина, воздух, водяной пар). Рабочее тело получает (или отдает) тепловую энергию в процессе теплообмена с телами, имеющими большой запас внутренней энергии. Эти тела называются тепловыми резервуарами.

Необратимый цикл – цикл, в котором хотя бы одна из его частей необратима. Эффективность необратимого цикла оценивается абсолютным внутренним коэффициентом полезного действия (i), под которым понимается отношение работы, совершенной в прямом необратимом термодинамическом цикле, к теплоте, сообщенной рабочему телу от внешних источников.
Коэффициент полезного действия теплового двигателя равен отношению работы А`, совершенной двигателем за один цикл, к количеству теплоты Q1, полученной от нагревателя:
![]()

Термическим КПД цикла называют отношение работы цикла к количеству теплоты, подведенной к рабочему телу в цикле. Обозначая термический КПД цикла ηт, получаем в соответствии с этим определением:
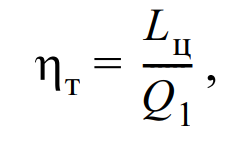
Термический КПД цикла характеризует степень совершенства того или иного цикла: чем больше ηт, тем совершеннее цикл; при подводе к рабочему телу одного и того же количества теплоты Q1 в цикле, у которого ηт больше, производится большая работа Lц.
Источник теплоты – ТС, способная отдавать или воспринимать теплоту и характеризующаяся определенной неизменной температурой.
Холодильная машина – устройство непрерывного действия, получающее энергию в форме теплоты и в форме работы, которая затем передается окружению в форме теплоты, при этом температура теплоотдатчика ниже температуры теплоприемника.
Термодинамический цикл, в котором к рабочему телу подводится меньшее количество теплоты и при меньшей температуре, а отводится большее количество теплоты и при более высокой температуре, разность же этих теплот равна затраченной работе.
Холодильный коэффициент (), под которым понимается отношение теплоты, отведенной в обратном термодинамическом цикле от охлаждаемой системы, к работе, затраченной в этом цикле:
![]()
