
- •Современное состояние энергетики рб и пути ее развития. Предмет и метод термодинамики.
- •Термодинамические параметры состояния. Термодинамическая система. Термодинамическая поверхность. Термодинамический процесс. Виды термодинамического процесса.
- •Эквивалентность теплоты и работы. Первый закон термодинамики. Уравнение первого закона термодинамики.
- •Работа расширения. Круговой процесс.
- •Внутренняя энергия и энтальпия как функции состояния. Удельная внутренняя энергия.
- •Идеальный газ. Основные законы идеального газа (Гей-Люссака, Шарля, Бойля-Мариотта). Уравнение состояния идеального газа. Уравнение состояния идеального газа для одного киломоля.
- •Закон а. Авогадро (2 следствия из закона). Понятие о моле и киломоле.
- •Теплоемкость (мольная, массовая, объемная, средняя, истинная). Теплоемкость идеального газа. Ср и Сv теплоёмкости. Связь между Ср и Сv.
- •Изобарный, изохорный, изотермический процессы изменения состояния идеального газа.
- •Адиабатный и политропный процессы изменения состояния идеального газа.
- •Второй закон термодинамики и его значение. Основная формулировка. Циклы. Тепловой двигатель. Рабочее тело. Понятие термического кпд. Источники теплоты
- •Цикл Саади Карно. Термический кпд цикла Карно.
- •Энтропия, как функция состояния. Изменение энтропии в необратимых процессах
- •Цикл Отто.
- •Цикл Дизеля.
- •Цикл Тринклера
- •Водяной пар. Парообразование. Испарение. Кипение. Конденсация. Конденсат. Сублимация. Десублимация. Уравнение состояния реальных газов.
- •Насыщенный пар. Сухой насыщенный пар. Влажный насыщенный пар. Степень сухости пара. Степень влажности пара. Перегретый пар.
- •Процесс парообразования на
- •Is (hs)-диаграмма состояния воды и водяного пара:
- •Основные параметры жидкости и сухого насыщенного пара.
- •Основные параметры влажного насыщенного пара. Основные параметры перегретого пара.
- •Термодинамические процессы изменения состояния водяного пара.
- •Изохорное изменение состояния пара
- •Изобарное изменение состояния пара
- •Изотермическое изменение состояния пара
- •Адиабатное изменение состояния водяного пара
- •Цикл Ренкина.
- •Цикл Ренкина в Ts-диаграмме
- •Цикл пту с промежуточным перегревом пара.
- •Регенеративный цикл пту.
- •Теплофикационный цикл пту.
- •Парогазовый цикл.
- •Схемы тепловых электрических станций.
- •Тепловая схема тэс
- •Атомные станции.
- •Тепловая схема аэс
- •Температурное поле. Температурный градиент. Условия однозначности.
- •Тепловой поток. Закон теплопроводности Фурье. Коэффициент теплопроводности.
-
Закон а. Авогадро (2 следствия из закона). Понятие о моле и киломоле.
Известный физический закон Авогадро для идеального газа устанавливает, что в равных объемах V различных идеальных газов при одинаковых давлении p и температуре T содержится одинаковое число молекул N. Число молекул в киломоле вещества называется числом Авогадро NА=6,0231026 кмоль-1.
Из закона Авогадро вытекают два важных следствия.
Следствие 1 из закона Авогадро. Один моль любого газа при одинаковых условиях занимает одинаковый объем.
В
частности при нормальных условиях объем
одного моля идеального газа равен 22,4
л. Этот объем называют молярным
объемом
![]() :
:
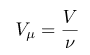
Следствие
2 из закона Авогадро. Отношение
масс одинаковых объемов двух газов есть
величина постоянная для данных газов.
Эта величина называется относительной
плотностью
![]() :
:

Понятие о моле и киломоле. Моль определяется как количество вещества, в котором содержится столько структурных элементов, сколько атомов углерода содержится в 0,012 кг изотопа углерода 12С (соответственно киломоль — в 12 кг этого изотопа). Так, например, киломоль кислорода (O2) равен 32 кг, киломоль углекислого газа (СО2) — 44 кг и т.д. Понятно, что 1 кмоль = 1000 моль.
-
Теплоемкость (мольная, массовая, объемная, средняя, истинная). Теплоемкость идеального газа. Ср и Сv теплоёмкости. Связь между Ср и Сv.
Теплоемкостью тела называют количество теплоты, необходимой для нагрева тела на один градус. Обозначается теплоемкость символом с. Размерность теплоемкости: [C] = Дж/К. Из приведенного определения теплоемкости следует (средняя теплоемкость):
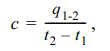
где t1 — начальная температура; t2 — конечная температура; q1-2 — теплота, подведенная к единице массы вещества в процессе нагрева от температуры t1 до температуры t2. Отсюда:

Истинная теплоемкость:
![]()
Удельная теплоёмкость (Суд) есть количество теплоты, необходимое для нагревания единицы массы вещества на 1 градус [Cуд] = Дж/К.
Массовой теплоемкостью (с) называют количество теплоты, необходимой для изменения температуры единицы массы вещества (обычно 1 кг или 1 г) на 1 °С.
Мольной теплоемкостью (сμ) называют теплоемкость, отнесенную к одному молю (или киломолю) вещества:
![]()
Объемной теплоемкостью (с’) называют теплоемкость, отнесенную к единице объема вещества (обычно 1 м3).
Очевидно, что
![]()
где ρ — плотность вещества.
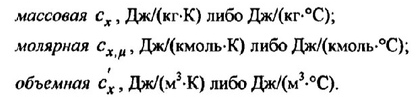

Теплоёмкость при постоянном объеме этом обозначается СV.
СР – теплоемкость при постоянном давлении.
Теплоемкость при постоянном объёме будет равна:
![]()
В общем случае
![]()
Теплоемкость при постоянном давлении будет равна:
![]()
Уравнение Майера для одного моля газа:
![]()

-
Изобарный, изохорный, изотермический процессы изменения состояния идеального газа.
Изопроцессы идеального газа – процессы, при которых один из параметров остаётся неизменным.

Изохорический процесс. Закон Шарля. V = const.
Изохорическим процессом называется процесс, протекающий при постоянном объёме V. Поведение газа при этом изохорическом процессе подчиняется закону Шарля:
При постоянном объёме и неизменных значениях массы газа и его молярной массы, отношение давления газа к его абсолютной температуре остаётся постоянным: P/Т = const.
График изохорического процесса на РV-диаграмме называется изохорой. Полезно знать график изохорического процесса на РТ- и VT-диаграммах.
Уравнение изохоры:
![]()

Изобарический процесс. Закон Гей-Люссака. Р = const.
Изобарическим процессом называется процесс, протекающий при постоянном давлении Р. Поведение газа при изобарическом процессе подчиняется закону Гей-Люссака:
При постоянном давлении и неизменных значениях массы и газа и его молярной массы, отношение объёма газа к его абсолютной температуре остаётся постоянным: V/T = const.
График изобарического процесса на VT-диаграмме называется изобарой. Полезно знать графики изобарического процесса на РV- и РT-диаграммах.

Уравнение изобары:
![]()
Изотермический процесс. Закон Бойля – Мариотта. T = const.
Изотермическим процессом называется процесс, протекающий при постоянной температуре Т.
Поведение идеального газа при изотермическом процессе подчиняется закону Бойля – Мариотта:
При постоянной температуре и неизменных значениях массы газа и его молярной массы, произведение объёма газа на его давление остаётся постоянным: PV = const.
График изотермического процесса на РV-диаграмме называется изотермой. Полезно знать графики изотермического процесса на VT- и РT-диаграммах.

Уравнение изотермы:
![]()
