
- •Современное состояние энергетики рб и пути ее развития. Предмет и метод термодинамики.
- •Термодинамические параметры состояния. Термодинамическая система. Термодинамическая поверхность. Термодинамический процесс. Виды термодинамического процесса.
- •Эквивалентность теплоты и работы. Первый закон термодинамики. Уравнение первого закона термодинамики.
- •Работа расширения. Круговой процесс.
- •Внутренняя энергия и энтальпия как функции состояния. Удельная внутренняя энергия.
- •Идеальный газ. Основные законы идеального газа (Гей-Люссака, Шарля, Бойля-Мариотта). Уравнение состояния идеального газа. Уравнение состояния идеального газа для одного киломоля.
- •Закон а. Авогадро (2 следствия из закона). Понятие о моле и киломоле.
- •Теплоемкость (мольная, массовая, объемная, средняя, истинная). Теплоемкость идеального газа. Ср и Сv теплоёмкости. Связь между Ср и Сv.
- •Изобарный, изохорный, изотермический процессы изменения состояния идеального газа.
- •Адиабатный и политропный процессы изменения состояния идеального газа.
- •Второй закон термодинамики и его значение. Основная формулировка. Циклы. Тепловой двигатель. Рабочее тело. Понятие термического кпд. Источники теплоты
- •Цикл Саади Карно. Термический кпд цикла Карно.
- •Энтропия, как функция состояния. Изменение энтропии в необратимых процессах
- •Цикл Отто.
- •Цикл Дизеля.
- •Цикл Тринклера
- •Водяной пар. Парообразование. Испарение. Кипение. Конденсация. Конденсат. Сублимация. Десублимация. Уравнение состояния реальных газов.
- •Насыщенный пар. Сухой насыщенный пар. Влажный насыщенный пар. Степень сухости пара. Степень влажности пара. Перегретый пар.
- •Процесс парообразования на
- •Is (hs)-диаграмма состояния воды и водяного пара:
- •Основные параметры жидкости и сухого насыщенного пара.
- •Основные параметры влажного насыщенного пара. Основные параметры перегретого пара.
- •Термодинамические процессы изменения состояния водяного пара.
- •Изохорное изменение состояния пара
- •Изобарное изменение состояния пара
- •Изотермическое изменение состояния пара
- •Адиабатное изменение состояния водяного пара
- •Цикл Ренкина.
- •Цикл Ренкина в Ts-диаграмме
- •Цикл пту с промежуточным перегревом пара.
- •Регенеративный цикл пту.
- •Теплофикационный цикл пту.
- •Парогазовый цикл.
- •Схемы тепловых электрических станций.
- •Тепловая схема тэс
- •Атомные станции.
- •Тепловая схема аэс
- •Температурное поле. Температурный градиент. Условия однозначности.
- •Тепловой поток. Закон теплопроводности Фурье. Коэффициент теплопроводности.
-
Внутренняя энергия и энтальпия как функции состояния. Удельная внутренняя энергия.
Внутренняя энергия – функция состояния ТС, определяемая тем, что ее приращение в любом процессе, происходящем в закрытой системе, равно сумме теплоты, сообщенной системе, и работе, совершенной над ней.
Всякая ТС имеет однозначную функцию состояния, называемую внутренней энергией, изменяющуюся только под влиянием внешних воздействий в процессе перехода системы из одного состояния в другое.
В тех случаях, когда в некотором процессе изменения состояния закрытой ТС ее кинетическая и потенциальная составляющие энергии как единого тела, не изменяются, равенство принимает вид
![]()
При бесконечно малом изменении состояния закрытой ТС имеем:
![]()
Для однородной системы массой М можно записать
U = Mu,
где u, Дж/кг, - удельная внутренняя энергия.
Энтальпия – функция состояния ТС, равная сумме внутренней энергии и произведения объема на давление:
H = U + pV.
Энтальпия является экстенсивным параметром и может относиться ко всей ТС (H, Дж) или к единице вещества ТС, тогда она называется удельной энтальпией – h, кДж/кг.
-
Идеальный газ. Основные законы идеального газа (Гей-Люссака, Шарля, Бойля-Мариотта). Уравнение состояния идеального газа. Уравнение состояния идеального газа для одного киломоля.
Идеальный газ – газ, равновесное состояние которого для одного моля описывается уравнением
рv= RT,
где р, Па, – давление, v, м3/кмоль, - молярный объем, R, Дж/(кмольК), - универсальная газовая постоянная, Т, К, - термодинамическая температура.
Это уравнение получило название Клапейрона - Менделеева.
Для одного килограмма вещества уравнение состояния идеального газа имеет вид
рv= RT,
где v, м3/кг, - удельный объем; R, Дж/(кгК), - газовая постоянная.
![]()
Газовая постоянная – характерная для каждого газа постоянная, входящая в уравнение состояния для одного килограмма идеального газа, численно равная отношению универсальной газовой постоянной к массе моля данного газа
R = R /.

Изобарический процесс. Закон Гей-Люссака. Р = const.
Изобарическим процессом называется процесс, протекающий при постоянном давлении Р. Поведение газа при изобарическом процессе подчиняется закону Гей-Люссака:
При постоянном давлении и неизменных значениях массы и газа и его молярной массы, отношение объёма газа к его абсолютной температуре остаётся постоянным: V/T = const.
График изобарического процесса на VT-диаграмме называется изобарой. Полезно знать графики изобарического процесса на РV- и РT-диаграммах
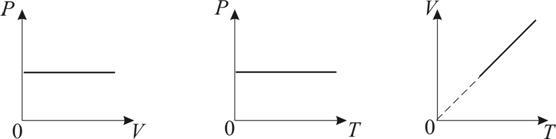
Уравнение изобары:
![]()
Изохорический процесс. Закон Шарля. V = const.
Изохорическим процессом называется процесс, протекающий при постоянном объёме V. Поведение газа при этом изохорическом процессе подчиняется закону Шарля:
При постоянном объёме и неизменных значениях массы газа и его молярной массы, отношение давления газа к его абсолютной температуре остаётся постоянным: P/Т = const.
График изохорического процесса на РV-диаграмме называется изохорой. Полезно знать график изохорического процесса на РТ- и VT-диаграммах
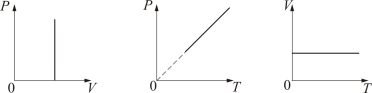
Уравнение изохоры:
![]()
Изотермический процесс. Закон Бойля – Мариотта. T = const.
Изотермическим процессом называется процесс, протекающий при постоянной температуре Т.
Поведение идеального газа при изотермическом процессе подчиняется закону Бойля – Мариотта:
При постоянной температуре и неизменных значениях массы газа и его молярной массы, произведение объёма газа на его давление остаётся постоянным: PV = const.
График изотермического процесса на РV-диаграмме называется изотермой. Полезно знать графики изотермического процесса на VT- и РT-диаграммах

Уравнение изотермы:
![]()
