
- •Физическая химия неравновесных процессов (курс лекций)
- •Содержание
- •3. Ионные равновесия в растворах электролитов 56
- •4. Электродные процессы и электродвижущие силы 61
- •Введение
- •I. Химическая кинетика
- •1. Основные понятия химической кинетики
- •1.1. Классификация химических реакций
- •1.2. Элементарные химические реакции
- •1.3. Скорость химической реакции
- •1.4. Кинетические кривые и кинетические уравнения
- •1.5. Молекулярность и порядок реакции
- •2. Элементарный акт химического превращения
- •2.1. Теория переходного состояния или активированного комплекса
- •2.2. Односторонние (необратимые) реакции I порядка
- •2.3. Односторонние реакции II порядка
- •2.4. Односторонние реакции nго порядка
- •2.5. Методы определения порядка реакции
- •3. Сложные химические реакции
- •3.1 Обратимые (двусторонние) реакции первого порядка
- •3.2. Параллельные односторонние реакции
- •3.3. Односторонние последовательные реакции
- •4. Зависимость скорости химической реакции от температуры. Уравнение Аррениуса.
- •5. Гетерогенные химические реакции
- •6. Каталитические реакции (катализ)
- •6.1. Свойства катализаторов
- •6.2. Каталитическая активность и избирательность
- •6.3. Кислотно-основной катализ
- •6.4. Гетерогенный катализ. Теории гетерогенного катализа
- •II Электрохимия
- •1. Общие понятия об электрохимических системах
- •Предмет электрохимии
- •1.2. Проводники электрических зарядов
- •1.3. Электролиз. Законы Фарадея.
- •2. Растворы электролитов и их свойства
- •2.1. Сильные и слабые электролиты
- •2.2. Электролитическая диссоциация в растворе
- •2.3. Механизм переноса тока в растворах электролитов. Числа переноса
- •2.4. Удельная и электровалентная электрические проводимости растворов электролитов
- •2.5. Молярная электрическая проводимость
- •2.6. Молярная электрическая проводимость ионов гидроксония и гидроксида
- •2.7. Влияние природы растворителя на предельную подвижность ионов
- •2.8. Зависимость молярной электропроводимости от температуры
- •3. Ионные равновесия в растворах электролитов
- •3.1. Термодинамическая константа диссоциации растворов электролитов
- •3.2. Диссоциация воды. Ионное произведение воды
- •4. Электродные процессы и электродвижущие силы.
- •4.1. Эдс электрохимической системы. Электродный потенциал
- •Строение дэс на границе раствор-металл
- •4.3. Устройство и изображение гальванического элемента
- •4.4. Компенсационный метод измерения эдс
- •4.5. Термодинамика гальванического элемента
- •4.6. Вывод уравнения Нернста для расчета эдс гальванического элемента
- •Литература
6. Каталитические реакции (катализ)
Каталитическими называются реакции, протекающие с участием катализаторов-веществ, не входящих в стехиометрическое уравнение и остающихся после реакции неизменными. Катализаторы вступают в промежуточное химическое взаимодействие с участками реакции, а после реакции выделяются.
Катализаторы сильно влияют на скорость реакции:
положительный катализ – увеличивают скорость реакции;
отрицательный катализ – понижают скорость реакции.
Вещества, в присутствии которых скорость реакции уменьшается, называются ингибиторами.
Если катализатором является один из продуктов реакции, то реакция называется автокаталитической.
![]()
Реакция восстановления окси железа катализируется железом.
Каталитические реакции широко распространены в природе и промышленности.
Различают: 1) гомогенный катализ
2) гетерогенный катализ
При гомогенном катализе все вещества находятся в общей фазе, включая катализатор. Реакция окисления SO2 в присутствии окси азота NO:
![]()
При гетерогенном катализе реагирующие вещества и катализатор находятся в разных фазах, а каталитическая реакция протекает на поверхности раздела фаз.
![]()
6.1. Свойства катализаторов
Свойства катализаторов: (kt)
катализатор не влияет на положение термодинамического равновесия, т.е на величину константы равновесия
![]() (1.85)
(1.85)
катализаторы обладают избирательностью (или селективностью действия). Каждый катализатор может ускорять лишь некоторые реакции.
Ni – катализатор реакции гидрирования
V2O5 – катализатор реакции окисления
Для каталитического
действия обычно достаточно малое
количество катализатора. Влияние kt
на скорость процесса характеризуется
удельной каталитической активностью,
за меру которой принимается скорость
реакции в присутствии kt,
отнесенная к единице количества kt
(гомогенный катализ) или к единице
поверхности kt
(гетерогенный катализ).
![]()
Механизм действия kt очень сложный. В присутствии kt:
снижается величина Eакт;
увеличивается скорость реакции;
kt может вызвать цепные реакции;
делает более вероятным протекание некоторых реакций.
Рассмотрим влияние катализатора на кинетику химических реакций на примере гомогенно-каталитической бимолекулярной односторонней реакции
![]()
Константа равновесия
образования активного комплекса
![]() равна
равна
![]() (1.86)
(1.86)
![]() -
концентрация активных комплексов;
-
концентрация активных комплексов;
![]() -
концентрация исходных веществ;
-
концентрация исходных веществ;
![]() -
концентрация катализатора, не вошедшего
в активный комплекс.
-
концентрация катализатора, не вошедшего
в активный комплекс.
Скорость реакции в присутствии катализатора
![]() (1.87)
(1.87)
Из уравнения (1.86)
значение
![]() ,
его подставим в уравнение (1.87), тогда
,
его подставим в уравнение (1.87), тогда
![]() (1.88)
(1.88)
Концентрация
свободного катализатора
![]()
![]() -
общая или исходная концентрация
катализатора
-
общая или исходная концентрация
катализатора
Из уравнения (1.86)
выразим отношение
![]() :
:
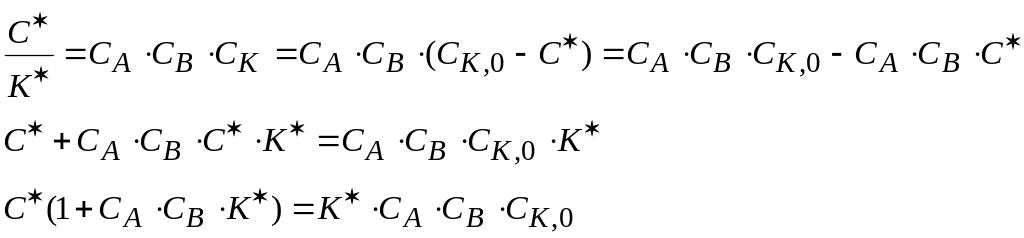
![]() (1.89)
(1.89)
Подставим это
значение
![]() в уравнение скорости
реакции
в уравнение скорости
реакции
![]() (1.90)
(1.90)
Уравнение (1.90) показывает, что скорость гомогенно-каталитической бимолекулярной реакции пропорциональна концентрации катализатора .
Анализ уравнения:
при малых значениях
 можно принять, что сумма
можно принять, что сумма
 ,
тогда уравнение (1.90) можно записать
,
тогда уравнение (1.90) можно записать
![]() (1.91)
(1.91)
Общий порядок реакции по исходным веществам – второй, а по веществам A или B – первый.
если значение велико, то
 и скорость реакции
и скорость реакции
![]() (1.92)
(1.92)
При этом реакция протекает по нулевому порядку (по исходным веществам).
при средних значениях порядок реакции по исходным веществам будет дробный.
Если каталитическая реакция
![]()
протекает в две стадии с образованием неустойчивого промежуточного соединения AK
![]()
то скорость реакции выражается уравнением (1.90)
![]() (1.93)
(1.93)
В присутствии
катализатора может протекать
термодинамически возможная реакция по
новому пути с образованием других
продуктов
![]() и
и
![]() ,
которые без катализатора практически
не образуются
,
которые без катализатора практически
не образуются
![]()
или
![]()
![]()
При образовании активного комплекса в присутствии катализатора энтропия активации уменьшается в присутствии kt по сравнению с энтропией активации без kt. Это приводит к уменьшению константы скорости реакции. Т.о., увеличение константы скорости реакции может быть связана только с уменьшением энергии активации реакции.
Константа скорости реакции образования активного комплекса может быть рассчитана по формуле
![]() (1.94)
(1.94)
![]() -
изобарный потенциал активации
-
изобарный потенциал активации
![]() -
трансмиссионный коэффициент прохождения
(≈1), для приближенных расчетов можно
не учитывать
-
трансмиссионный коэффициент прохождения
(≈1), для приближенных расчетов можно
не учитывать
![]() -
энтропия образования активного комплекса
-
энтропия образования активного комплекса
![]() -
энтальпия образования активного
комплекса
-
энтальпия образования активного
комплекса
k - const Больцмана
h - const Планка
T - температура
![]() -
зависит от энтальпии и энтропии активации.
-
зависит от энтальпии и энтропии активации.
