
- •Содержание
- •Введение
- •Общие рекомендации по оформлению
- •Варианты расчетно-графической (контрольной) работы №1
- •1 Водородный показатель среды
- •1.1 Теоретические пояснения
- •1.2 Примеры решения типовых задач
- •Перечень задач по теме 5
- •2 Жёсткость воды
- •2.1 Теоретические пояснения
- •2.2 Примеры решения типовых задач
- •Перечень задач по теме 6
- •3 Окислительно-восстановительные реакции
- •3.1 Теоретические пояснения
- •3.2 Примеры решения типовых задач
- •3.3 Перечень задач по теме 7
- •4 Гальванический элемент. Коррозия металлов
- •4.1 Теоретические пояснения
- •4.2 Примеры решения типовых задач
- •Перечень задач по теме 8
- •5 Список рекомендуемой литературы
- •Заключение
- •Использованная литература
- •241037. Г. Брянск, пр. Станке Димитрова, 3, редакционно-издательский
2.2 Примеры решения типовых задач
Пример 1
Рассчитайте общую жесткость воды (ммоль экв./л), если в 0,15 л воды содержится 16,2 мг гидрокарбоната кальция, 2,92 мг гидрокарбоната магния, 11,10 мг хлорида кальция и 9,50 мг хлорида магния.
Решение:
Учитывая соотношение
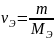 ,
,
выразим общую жесткость воды как сумму миллимолярных концентраций эквивалентов двухзарядных катионов металлов (или соответствующих им солей) в воде:
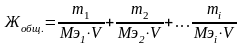 ,
,
где m1, m2, mi – массы двухзарядных катионов металлов, либо массы соответствующих им солей, либо массы веществ, пошедших на устранение жесткости воды, мг;
Mэ1, Mэ2, Mэi – молярные массы эквивалентов двухзарядных катионов металлов, либо массы соответствующих им солей, либо массы веществ, пошедших на устранение жесткости воды, г/моль;
V – объем воды, л.
Молярные массы эквивалентов солей, перечисленных в условии задачи, рассчитываются по формуле:
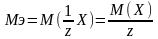 ,
,
где z – эквивалентное число, для солей жесткости оно равно 2;
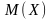 – молярная
масса соли Х.
– молярная
масса соли Х.
Формула соли |
Са(HCО3)2 |
Mg(HCО3)2 |
СаCl2 |
MgCl2 |
|
81 |
73 |
55,5 |
48 |
Общая жесткость данного образца воды равна сумме временной и постоянной жесткости:
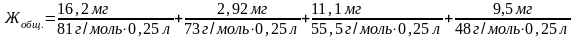 =
=
=2,56 ммоль экв./л
Пример 2
Определите временную жесткость воды, если на титрование 0,1 л воды, содержащей гидрокарбонат магния, израсходовано 7,2∙10-3 л 0,14н. раствора HCl.
Решение:
При титровании воды соляной кислотой происходит реакция:
Mg(HCO3)2 + 2НС1 = MgCl2 + 2Н2О + 2СО2
В титриметрическом методе при расчетах используется следствие из закона эквивалентов для двух реагирующих веществ (в нашем случае это гидрокарбонат магния и соляная кислота):
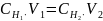 .
.
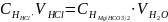
Временная жесткость воды, выраженная в ммоль экв./л, представляет собой фактически нормальную концентрацию соли жесткости, умноженную на 1000. Тогда
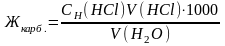 =
=
=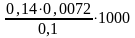 =10,08 ммоль
экв./л
=10,08 ммоль
экв./л
Ответ: 10,08 ммоль экв./л
Пример 3
Для устранения общей кальциевой жесткости по известково-содовому методу добавлено 7,4 г Са(ОН)2 и 5,3 г Na2CO3. Рассчитать временную и постоянную жесткость воды.
Решение:
Добавление к воде Са(ОН)2 может устранить временную жесткость, а добавление Na2CO3 – постоянную жесткость. При добавлении этих реагентов к воде происходят следующие реакции:
Ca(HCO3)2 + Ca(OH)2 ® 2CaCO3¯ + 2H2O
Ca(NО3)2 + Na2CO3 ® MeCO3¯ + 2NaNO3
Временную жесткость воды Жвр измеряют количеством вещества эквивалентов гидроксида кальция, участвующего в реакции, а постоянную жесткость Жпост – количеством вещества эквивалентов карбоната натрия.
M(1/2Са(ОН)2) = 74/2=37 г/моль;
M(1/2Na2CO3) = 106/2=53 г/моль;
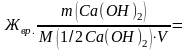 7400/(37∙50)
= 4 ммоль
экв./л;
7400/(37∙50)
= 4 ммоль
экв./л;
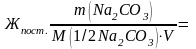 5300/(53∙50)
= 2 ммоль
экв./л
5300/(53∙50)
= 2 ммоль
экв./л
Общая жесткость воды равна:
Жобщ = Жвр + Жпост = 4 + 2 = 6 ммоль экв./л
Перечень задач по теме 6
В 10 л воды содержится 0,95 г хлорида магния и 1,62 г гидрокарбоната кальция. Определить карбонатную, некарбонатную (постоянную) и общую жесткость этого образца воды.
Чему равна жесткость (в ммоль/л) 0,005 М раствора СаCl2?
Растворимость СаSO4 в воде составляет 0,202%. Вычислите жесткость насыщенного раствора этой соли, принимая его плотность за 1,0 г/мл.
Для умягчения 100 л воды потребовалось 12,72 г Na2CO3. Чему равна жесткость образца воды в ммоль/л?
На титрование 0,05 л образца воды израсходовано 4,8∙10-3 л 0,1 н раствора HCl. Чему равна карбонатная жесткость воды?
Какую массу гашеной извести надо прибавить к 2,5 л воды, чтобы устранить ее временную жесткость, равную 4,43 ммоль/л?
При определении временной жесткости на титрование 0,1 л воды израсходовано 5,25∙10-3 литра 0,101н. раствора HCl. Вычислите жесткость этой воды.
Образец воды объемом 1 литр содержит 48,6 мг гидрокарбоната кальция и 29,6 мг сульфата магния. Какое количество Са2+ и Mg2+ содержится в 1 литре этой воды? Чему равна общая, постоянная и карбонатная жесткость воды?
Некарбонатная жесткость воды равна 3,18 ммоль/л. Какую массу Na3РO4 надо прибавить, чтобы устранить жесткость 1 м3 этой воды?
Для удаления карбонатной жесткости применяют одно из следующих веществ: NaOH, Ca(OH)2, Na3PO4. Какое из названных веществ окажется наиболее эффективным, если взять их одинаковые количества? Ответ обоснуйте уравнениями реакций и соответствующими расчетами.
Почему для регенерации катионита, использовавшегося для умягчения воды, его промывают раствором хлорида натрия, а затем водой? Можно ли применить для регенерации катионита раствор хлорида кальция?
Вода содержит 0,12 г/л растворенного гидрокарбоната кальция. Сколько нужно прибавить извести к 10 л такой воды, чтобы осадить гидрокарбонат в виде карбоната?
Какую реакцию среды имеет Na-катионированная вода, Н-катионированная вода? Почему при использовании реагентных методов не достигается полное удаление ионов Са2+ и Mg2+.
Почему при кипячении воды ее временная (устранимая) жесткость уменьшается? В чем химизм процесса? Наличием каких растворенных солей обусловлена постоянная жесткость? Почему она так называется?
Чему равна жесткость (в ммоль/л) 0,02 М раствора СаCl2?
Почему карбонатная жесткость воды обусловлена гидрокарбонатами кальция и магния? Каков механизм их появления в воде?
В 11 л воды содержится 1 г нитрата магния и 1,62 г гидрокарбоната кальция. Определить карбонатную, некарбонатную (постоянную) и общую жесткость этого образца воды.
Чему равна жесткость (в ммоль/л) 0,01 М раствора Са(NO3)2?
Растворимость СаSO4 в воде составляет 0,202%. Вычислите жесткость насыщенного раствора этой соли, принимая его плотность за 1,0 г/мл.
При 00С растворимость сульфата кальция 0,176 г на 100 г воды. Вычислить жесткость такого раствора, принимая его плотность равной 1 г/мл.
Чему равна жесткость (в ммоль/л) 0,015 М раствора Са(HCO3)2?
Для умягчения 10 л воды потребовалось 1,1 г Na2CO3. Чему равна жесткость образца воды в ммоль/л?
На титрование 0,03 л образца воды израсходовано 2∙10-3 л 0,1 н. раствора HCl. Чему равна карбонатная жесткость воды?
Какую массу гашеной извести надо прибавить к 5 л воды, чтобы устранить ее временную жесткость, равную 5 ммоль экв./л?
При определении временной жесткости на титрование 0,2 л воды израсходовано 4,25∙10-3 литра 0,101н. раствора HCl. Вычислите жесткость этой воды.
Образец воды объемом 2 литра содержит 80,6 мг гидрокарбоната кальция и 50,6 мг сульфата магния. Какое количество Са2+ и Mg2+ содержится в 1 литре этой воды? Чему равна общая, постоянная и карбонатная жесткость воды?
Некарбонатная жесткость воды равна 4 ммоль экв./л. Какую массу Na3РO4 надо прибавить, чтобы устранить жесткость 1 литра этой воды?
Чему равна жесткость (в ммоль/л) 0,03 М раствора Са(NO3)2?
Чему равна жесткость (в ммоль/л) 0,012 М раствора Mg(NO3)2?
Чему равна жесткость (в ммоль/л) 0,025 М раствора MgCl2?

 ,
г/моль
,
г/моль