
64. лекция « водные растворы элетролитов»
65. Изотонический коэффициент (также фактор Вант-Гоффа; обозначается i) — безразмерный параметр, характеризующий поведение вещества в растворе. Он численно равен отношению значения некоторого коллигативного свойства раствора данного вещества и значения того же коллигативного свойства неэлектролита той же концентрации при неизменных прочих параметрах системы:
![]() ,
,
где solut. — данный раствор, nel. solut. — раствор неэлектролита той же концентрации, Tbp — температура кипения, а Tmp — температура плавления (замерзания).
Значение понятия
Смысл параметра ясен из определения каждого из коллигативных параметров: они зависят от концентрации в растворе частиц растворённого вещества. Неэлектролиты в растворе не диссоциируют, стало быть, каждая молекула неэлектролита образует в растворе лишь одну частицу. В свою очередь, электролиты в растворе под влиянием сольватации частично или полностью распадаются на ионы, образуя при этом несколько частиц на одну диссоциировавшую молекулу. Соответственно, и коллигативные свойства данного раствора (аддитивные величины) зависят от содержания в нём частиц (ионов) каждого типа из тех, которым принадлежат частицы, образовавшиеся в растворе в результате диссоциации исходной молекулы, — раствор представляется как бы смесью растворов каждого из типов частиц. Например, раствор хлорной извести содержит три типа частиц — катионы кальция, хлорид-анионы и гипохлорит-анионы. Итак, изотонический коэффициент показывает, насколько в растворе электролита больше частиц по сравнению с раствором неэлектролита аналогичной концентрации, и связан со способностью вещества распадаться в растворе на ионы, то есть, со степенью диссоциации. Если формульная единица или молекула содержит n ионов (или атомов при полярных связях, в растворе превращающихся в ионы), количество исходных молекул равно N, а степень диссоциации соединения — α, то количество диссоциировавших молекул равно N·α (при этом образуются N·α·n ионов), а общее количество частиц в растворе равно ((N — N·α) + N·α·n).
Изотонический же коэффициент равен отношению:
![]() .
.
Изотонический коэффициент в растворах сильных электролитов
Поскольку сильные электролиты диссоциируют практически полностью, можно было бы ожидать для них изотонический коэффициент, равный количеству ионов (или поляризованных атомов) в формульной единице (молекуле). Однако в действительности этот коэффициент всегда меньше определённого по формуле. Например, изотонический коэффициент для 0,05-моляльного раствора NaCl равен 1,9 вместо 2,0 (для раствора сульфата магния той же концентрации и вовсе i = 1,3). Это объясняет теория сильных электролитов, разработанная в 1923 году П. Дебаем и Э. Хюккелем: передвижение ионов в растворе затруднено образовавшейся оболочкой сольватации. К тому же, ионы взаимодействуют и между собой: разноимённо заряженные притягиваются, а одноимённо заряженные — отталкиваются; силы взаимного притяжения приводят к образованию групп ионов, перемещающихся по раствору совместно. Такие группы называют ионными ассоциатами или ионными па́рами. Соответственно, раствор ведёт себя так, будто содержит меньше частиц, чем на самом деле, ведь свобода их перемещения ограничена. Наиболее очевиден пример, касающийся электропроводности растворов λ, которая возрастает с разбавлением раствора. Через отношение реальной электропроводности к таковой при бесконечном разбавлении определяют мнимую степень диссоциации сильных электролитов, также обозначаемую через α:
![]() ,
,
где nimg — мнимое, а ndisslv. — реальное количество частиц в растворе.
Влияние внешних факторов
Очевидно, что взаимодействие ионов уменьшается с повышением температуры (вследствие возросшего теплового движения частичек), а также с уменьшением их концентрации, то есть, разбавлением раствора, ведь тогда уменьшается вероятность встречи двух частичек. Экстраполируя разбавление в сторону бесконечности, коэффициент i стремится к своему максимальному значению, определяемому по формуле растворённого соединения. Степень диссоциации α, в соответствии с вышеупомянутой формулой зависимости между i и α, одновременно возрастает, приближаясь к единице (1).
Изотонический коэффициент был введён в последней четверти XIX века Я. Х. Вант-Гоффом. В 1901 году он первым получил Нобелевскую премию по химии — за свои заслуги в изучении растворов.
Также плюс лекция «Водные растворы электролитов»
66. лекция «растворы»
Растворимость выражается концентрацией растворённого вещества в его насыщенном растворе либо в процентах, либо в весовых или объёмных единицах, отнесённых к 100 г или 100 см³ (мл) растворителя (г/100 г или см³/100 см³). Растворимость газов в жидкости зависит от температуры и давления. Растворимость жидких и твёрдых веществ — практически только от температуры.
67. Произведение растворимости
Произведение растворимости (ПР, Ksp) — произведение концентрации ионов малорастворимого электролита в его насыщенном растворе при постоянной температуре и давлении. Произведение растворимости — величина постоянная.
При постоянной температуре в насыщенных водных растворах малорастворимых электролитов устанавливается равновесие между твердым веществом и ионами, образующими это вещество. Например, в случае для CaCO3 это равновесие можно записать в виде:
![]()
Константа этого равновесия рассчитывается по уравнению:
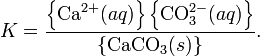
В приближении идеального раствора с учетом того, что активность чистого компонента равна единице, уравнение упрощается до выражения:
![]()
Константа равновесия такого процесса называется произведением растворимости.
В общем виде, произведение растворимости для вещества с формулой AmBn, которое диссоциирует на m ионов An+ и n ионов Bm-, рассчитывается по уравнению:
![]()
где [An+] и [Bm-] — равновесные молярные концентрации ионов, образующихся при электролитической диссоциации.
Из произведений растворимости можно рассчитать концентрации катионов и анионов в растворе малорастворимого электролита. Значения произведений растворимости приведены в справочниках.
Произведение активностей
Данное уравнение не учитывает коэффициенты активности, то есть степень влияния ионных сил. Для растворов с концентрациями большими, чем 1•10-4 моль/л необходимо использовать произведение активностей:
![]()
где аA и аB — активности ионов A и B.
Произведение активностей ионов для насыщенных растворов малорастворимых электролитов при данной температуре постоянная величина. Она зависит от температуры и природы растворителя.
Произведение растворимости связано с растворимостью следующим соотношением:
![]()
где:
m+n — суммарное количество молей катионов и анионов
m — количество молей катиона
n — количество молей аниона
Ksp — произведение растворимости
S — растворимость вещества (моль/л)
Также плюс лабораторная работа «Малорастворимые электролиты. Произведение растворимости»
68. лекция номер 12.( перед лекцией «Теория кислот и оснований»)
69. Ионное произведение воды
Материал из Википедии — свободной энциклопедии
Ио́нное произведе́ние воды́ — произведение концентраций ионов водорода Н+ и ионов гидроксида OH− в воде или в водных растворах, константа автопротолиза воды.
|
|
Вывод значения ионного произведения воды
Вода, хотя и является слабым электролитом, в небольшой степени диссоциирует:
H2O + H2O ↔ H3O+ + OH−
или
H2O ↔ H+ + OH−
Равновесие этой реакции сильно смещено влево. Константу диссоциации воды можно вычислить по формуле:
|
(1) |
где:
[H+] — концентрация ионов гидроксония (протонов);
[OH−] — концентрация гидроксид-ионов;
[H2O] — концентрация воды (в молекулярной форме) в воде;
Концентрация воды в воде, учитывая её малую степень диссоциации, величина практически постоянная и составляет (1000 г/л)/(18 г/моль) = 55,56 моль/л.
При 25 °C константа диссоциации воды равна 1,8×10−16моль/л. Уравнение (1) можно переписать как:
|
(2) |
Обозначим произведение K·[H2O] = Kв = 1,8×10−16 моль/л·55,56 моль/л = 10−14моль²/л² = [H+]·[OH−] (при 25 °C).
Константа Kв, равная произведению концентраций протонов и гидроксид-ионов, называется ионным произведением воды. Она является постоянной не только для чистой воды, но также и для разбавленных водных растворов веществ. C повышением температуры диссоциация воды увеличивается, следовательно, растёт и Kв, при понижении температуры — наоборот.
Практическое значение ионного произведения воды
Практическое значение ионного произведения воды велико, так как оно позволяет при известной кислотности (щёлочности) любого раствора (то есть при известной концентрации [H+] или [OH−]) найти соответственно концентрации [OH−] или [H+]. Хотя в большинстве случаев для удобства представления пользуются не абсолютными значениями концентраций, а взятыми с обратными знаком их десятичными логарифмами — соответственно, водородным показателем (pH) и гидроксильным показателем (pOH).
Так
как Kв —
константа, при добавлении к раствору
кислоты (ионов H+),
концентрация гидроксид-ионов OH−
будет падать и наоборот. В нейтральной
среде [H+]
= [OH−]
=
![]() моль/л.
При концентрации [H+]
> 10−7
моль/л (соответственно, концентрации
[OH−]
< 10−7
моль/л) среда будет кислой;
При концентрации [OH−]
> 10−7
моль/л (соответственно, концентрации
[H+]
< 10−7
моль/л) — щелочной.
моль/л.
При концентрации [H+]
> 10−7
моль/л (соответственно, концентрации
[OH−]
< 10−7
моль/л) среда будет кислой;
При концентрации [OH−]
> 10−7
моль/л (соответственно, концентрации
[H+]
< 10−7
моль/л) — щелочной.
Ионные произведения других растворителей
Ионное произведение можно рассчитать не только для воды. Ионное произведение воды является лишь одной (хотя практически наиболее важной) из констант автопротолиза.
Автопротолиз – гомофазный процесс самоионизации, обратимый процесс передачи протона от одной нейтральной молекулы жидкости к другой и образования в результате равного числа катионов и анионов.
Константа автопротолиза
Применение закона действующих масс к равновесной гомофазной реакции автопротолиза позволяет получить количественную характеристику — константу автопротолиза (иначе ионное произведение) растворителя KS. Термин «константа автопротолиза» используется обычно в протолитической теории, а «ионное произведение» — в теории электролитической диссоциации[2].
Для протонного растворителя HL может быть записана соответствующая константа равновесия: Kс = [L-] · [H2L+] / [HL]2 = Const = f (T)
Степень протолиза очень мала и, следовательно, равновесная молярная концентрация непротолизованных молекул растворителя [HL] практически равна исходной концентрации этого растворителя CHL, то есть постоянна.
Объединяя постоянные Kс и [HL]2 в одну константу Kс · [HL]2 и обозначая ее Ks, получим выражение:
Ks = [L-] . [H2L+] = Const = f (T).
Величина Ks — константа автопротолиза или ионное произведение растворителя — служит количественной характеристикой реакции автопротолиза данного растворителя. Константа автопротолиза является постоянной величиной для данной температуры и данного растворителя.
Например, для уксусной кислоты:
CH3COOH
+ CH3COOH
![]() CH3COO-(s)
+ CH3COOH2+(s);
Ks
= 2,5·10-13
(20 °C)
CH3COO-(s)
+ CH3COOH2+(s);
Ks
= 2,5·10-13
(20 °C)
Поскольку значения констант автопротолиза очень малы, на практике для удобства пользуются величиной, которая называется «показатель константы автопротолиза». Она рассчитывается как отрицательный десятичный логарифм константы автопротолиза:
![]() .
.
Условия образования осадка Осадок MeAn образуется, когда значение ионного произведения [Me+][An -] превысит значение произведения растворимости KS(MeAn), т. е. когда возникает местное пересыщение раствора. В этом месте появляются зародыши будущего кристалла (процесс зародышеобразования). С момента смешения растворов до появления зародышей проходит определенное время, называемое индукционным периодом (от долей секунды до нескольких минут). При дальнейшем прибавлении осадителя более вероятным становится процесс роста кристаллов, а не дальнейшее образование зародышей. Зародыши соединяются в более крупные агрегаты, состоящие из десятков и сотен молекул (процесс агрегации). Эта стадия соответствует коллоидным системам.
Размер частиц затем увеличивается, и крупные агрегаты под действием сил тяжести выпадают в осадок. На этой стадии отдельные частицы, будучи диполями, ориентируются по отношению друг к другу так, что их противоположно заряженные стороны сближаются (процесс ориентации). Если скорость ориентации больше скорости агрегации, то образуется правильная кристаллическая решетка, в противном случае выпадает аморфный осадок. Чем менее растворимо вещество, тем быстрее образуется осадок и мельче кристаллы. Одни и те же малорастворимые вещества в зависимости от условий осаждения могут быть выделены как в кристаллическом, так и в аморфном состояниях, что определяется условиями осаждения.
Условия осаждения кристаллических и аморфных осадков Скорости процессов агрегации и ориентации определяются относительным пересыщением (Q-S)/S (Q – молярная концентрация смешиваемых реагентов до начала осаждения, Q=C/2; S – молярная растворимость осадка после установления равновесия). Эта эмпирическая формула справедлива при смешении разных объемов растворов с одинаковой концентрацией реагирующих веществ. Чем ниже растворимость осадка S и чем выше концентрация реагирующих веществ Q, тем больше образуется зародышей и тем больше скорость агрегации. И наоборот, чем меньше разность Q-S, т. е. чем выше растворимость осадка и ниже концентрация осаждаемого вещества, тем выше скорость ориентации. Таким образом, для получения крупнокристаллического осадка, который легко фильтровать и промывать, необходимо проводить осаждение из разбавленных растворов медленным прибавлением осадителя и при нагревании.
Аморфные осадки склонны к коллоидообразованию. Поэтому при осаждении нужно создать условия, способствующие коагуляции коллоидных растворов. Для этого осаждение аморфных осадков проводят из концентрированных растворов концентрированным раствором осадителя при нагревании до 70-80º С и непрерывном помешивании.
Процесс коагуляциии коллоидных растворов может быть вызван прибавлением какого-либо электролита-коагулятора (например, кислоты или различных солей аммония). Фильтрование аморфных осадков следует проводить сразу после осаждения.
70. лекция «водные растворы электролитов»
Реакция ионного обмена — одна из видов химической реакции, характеризующаяся выделением в продукты реакции воды, газа или осадка.
Реакцию обмена в растворе принято изображать тремя уравнениями: молекулярным, полным ионным и сокращённым ионным. В ионном уравнении слабые электролиты, газы и малорастворимые вещества изображают молекулярными формулами.
Na2CO3 + H2SO4 → Na2SO4 + CO2↑ +H2O
2Na+ + CO32- + 2H+ + SO42- → 2Na+ + SO42- + CO2↑ + H2O
CO32- + 2H+ → CO2↑ + H2O
71. Протолитическая (протонная) теория кислот и оснований — химическая теория, предложенная в 1923 году независимо датским учёным Брёнстедом и английским учёным Лоури. Согласно этой теории кислотами являются вещества, молекулы или ионы, отщепляющие при данной реакции протоны, а
основаниями являются вещества, молекулы или ионы, присоединяющие протоны. Кислоты и основания получили общее название протолитов.
Лекция «Теория кислот и оснований»
72. Лекция «Теория кислот и оснований»
Плюс лабораторная работа «Гидролиз солей»
73. Лекция «Теория кислот и оснований»
Плюс лабораторная работа «Гидролиз солей»
74. Лекция «Теория кислот и оснований»
Плюс лабораторная работа «Гидролиз солей»
