
- •Содержание
- •Введение
- •Общие рекомендации по оформлению
- •Варианты расчетно-графической (контрольной) работы №1
- •1 Водородный показатель среды
- •1.1 Теоретические пояснения
- •1.2 Примеры решения типовых задач
- •Перечень задач по теме 5
- •2 Жёсткость воды
- •2.1 Теоретические пояснения
- •2.2 Примеры решения типовых задач
- •Перечень задач по теме 6
- •3 Окислительно-восстановительные реакции
- •3.1 Теоретические пояснения
- •3.2 Примеры решения типовых задач
- •3.3 Перечень задач по теме 7
- •4 Гальванический элемент. Коррозия металлов
- •4.1 Теоретические пояснения
- •4.2 Примеры решения типовых задач
- •Перечень задач по теме 8
- •5 Список рекомендуемой литературы
- •Заключение
- •Использованная литература
- •241037. Г. Брянск, пр. Станке Димитрова, 3, редакционно-издательский
1 Водородный показатель среды
1.1 Теоретические пояснения
Электролитическая диссоциация – это распад вещества в растворе на сольватированные (в случае водной среды на гидратированные) ионы под действием молекул растворителя.
Степень диссоциации a есть отношение числа молекул, подвергшихся в растворе распаду на ионы, к общему числу растворенных молекул. По степени диссоциации в растворах электролиты подразделяются на сильные и слабые.
Для сильных электролитов a = 1 (диссоциация полная) и не зависит от концентрации раствора. К ним относятся водные растворы подавляющего числа солей, гидроксидов щелочных и щелочноземельных металлов, ряда кислот (HCl, HBr, HI, HClO4, HNO3, H2SO4, H2SeO4 и другие).
Для слабых электролитов a < 1 и уменьшается с ростом концентрации раствора. К слабым электролитам относятся водные растворы аммиака, некоторых органических азотсодержащих соединений (гидразин NH2NH2, гидроксиламин NH2OH, и др.), таких кислот, как HNO2, H3BO3, H2CO3, CH3COOH, H2SO3, HOCl, HCN, водный раствор H2S и другие).
В растворах слабых электролитов устанавливается диссоционное равновесие, характеризующееся константой диссоциации. Многоосновные слабые кислоты и многокислотные слабые основания диссоциируют ступенчато, в их растворах устанавливается сложное равновесие между недиссоциированными молекулами и ионами различного знака.
Связь между константой диссоциации слабого электролита и его степенью диссоциации выражается законом разбавления Оствальда.
Пусть электролит диссоциирует на два иона – положительный катион и отрицательный анион:
КА ⇆ К+ + А–.
Для такого электролита закон разбавления Оствальда записывается в виде
Кд=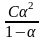 , (1.1.1)
, (1.1.1)
где Кд – константа диссоциации электролита;
С – молярная концентрация;
α – степень диссоциации.
Если для слабого электролита выполняется условие α<<1, то справедливо приближенное равенство
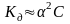 (1.1.2)
(1.1.2)
Поскольку растворы электролитов значительно отличаются по свойствам от идеальных растворов, то при расчетах следует пользоваться не концентрациями, а активностями ионов, в соответствии с которыми ионы проявляют свое действие. Активность а определяется выражением:
a=f×C,
где f – коэффициент активности ионов, зависящий от концентрации и состава раствора, заряда, природы иона, температуры и других факторов;
С – концентрация ионов.
Активности ионов связаны с их молярными концентрациями аналогичными соотношениями:
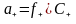
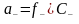 , (1.1.3)
, (1.1.3)
где f – молярный коэффициент активности, формально учитывающий все отклонения реальных растворов от идеальных.
Существует ряд экспериментальных и теоретических способов определения коэффициентов активности.
В разбавленных растворах (С не превышает 0,5моль/л) можно приближенно считать, что коэффициент активности зависит только от заряда иона и ионной силы раствора, которая вычисляется по формуле:
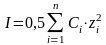 , (1.1.4)
, (1.1.4)
где Сi – концентрации ионов;
zi – заряды всех находящихся в растворе ионов.
В последней формуле под Сi строго следует понимать моляльность ионов, однако в разбавленных растворах, для которых справедлива эта формула, моляльность по величине мало отличается от молярности.
В разбавленных растворах коэффициент активности f мало зависит от природы растворенных веществ. Для таких растворов при 298 К средний коэффициент активности ионов электролита можно рассчитать по формуле Дебая-Гюккеля в первом приближении:
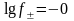 ,
,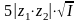 . (1.1.5)
. (1.1.5)
Для приближенного нахождения коэффициентов активности также можно воспользоваться справочными таблицами. В таблице 1.1.1 приведена зависимость коэффициентов активности ионов Н+ и ОН- от ионной силы раствора.
Таблица 1.1.1 – Зависимость активности ионов от ионной силы раствора
Ионы |
Коэффициенты активности при заданной ионной силе раствора |
|||||||
0,001 |
0,002 |
0,005 |
0,01 |
0,02 |
0,05 |
0,1 |
0,2 |
|
Н+ |
0,975 |
0,967 |
0,950 |
0,923 |
0,914 |
0,880 |
0,860 |
0,830 |
ОН- |
0,975 |
0,964 |
0,946 |
0,926 |
0,900 |
0,855 |
0,810 |
0,760 |
В сильно разбавленных растворах коэффициент активности приближается к единице, поэтому для не очень точных расчетов различием между активностью и концентрацией можно пренебречь.
Кислотность или щелочность раствора принято характеризовать водородным показателем среды рН.
Водородный показатель среды рН водного раствора равен взятому с обратным знаком десятичному логарифму активности ионов водорода в этом растворе:
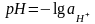 (1.1.6)
(1.1.6)
Среда водного раствора электролита может быть кислой, нейтральной или щелочной. Носителями кислотных свойств являются ионы Н+, за основные свойства водных растворов отвечают ионы ОН-.
Чистая вода является слабым электролитом. Ее электролитическая диссоциация протекает в соответствии с уравнением:
Н2О D Н + + ОН –,
при этом образуется равное количество катионов водорода и гидроксид-анионов.
Константа диссоциации воды выражается следующим образом:
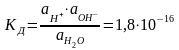 . (1.1.7)
. (1.1.7)
При 220С она равна 1,8·10-16. Активность чистой воды при той же температуре равна примерно 55,56 моль/л. Тогда из выражения (1.1.7) следует:
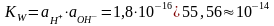 (1.1.8)
(1.1.8)
Величина
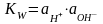 носит название ионного произведения
воды. При 220С
КW=10-14.
носит название ионного произведения
воды. При 220С
КW=10-14.
В
чистой воде и в нейтральных растворах
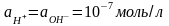 (рН=7).
(рН=7).
В
кислых растворах
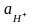 > 10-7моль/л
(рН < 7).
> 10-7моль/л
(рН < 7).
В щелочных растворах < 10-7моль/л (рН > 7).
Наряду с водородным показателем рН в ряде случаев используют показатель рОН, равный взятому с обратным знаком десятичному логарифму активности гидроксид-ионов.
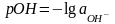 (1.1.9)
(1.1.9)
Путем логарифмирования и умножения на -1 выражения (1.1.8) можно прийти к следующему соотношению:
рН + рОН = 14 (1.1.10)
При проведении расчетов рН нужно учитывать, что сильные кислоты и основания диссоциируют практически полностью, степень диссоциации α=1. Для слабых кислот и оснований диссоциация частичная. Для них выполняется закон разбавления Оствальда и при расчетах необходимо иметь в виду зависимость между константой и степенью диссоциации.
