
- •Міністерство освіти і науки України Донбаська національна академія будівництва і архітектури
- •Конспект лекцій
- •101 «Екологія», 133 «Галузеве машинобудування»,
- •192 «Будівництво та цивільна інженерія», 274 «Автомобільний транспорт»
- •Тема 2 Періодичний закон та періодична система д.І.Менделєєва……………………..15
- •1. Научные открытия, подтвердившие сложность строения атомов
- •Шрёдингер Эрвин
- •3. Квантовые числа
- •4. Строение многоэлектронных атомов
- •Гунд Фридрих
- •Паули Вольфганг
- •4.2 Правило Гунда
- •Тема № 2 _Периодический закон и периодическая система д.И.Мендилеева
- •Формулировка и физический смысл периодического закона.
- •Зависимость от положения в периодической системе энергии ионизации, сродства к электрону, относительной электроотрицательности.
- •4.Седения об элементах, получаемые из таблицы д.И.Менделеева.
- •-Высшую и низшую степени окисления элемента. Тема № 3 _Химическая связь
- •Химическая связь. Ее характеристики
- •3. Типы химической связи:
- •3. Квантово-химические методы описания химической связи.
- •Тема № 4 _Химическая термодинамика
- •Введение в химическую термодинамику.
- •1.1 Основные понятия термохимии.
- •1.2 Первый закон термодинамики для различных процессов.
- •2.Термодинамические функции состояния.
- •2.1.Энтальпия. Закон Гесса.
- •Закон Гесса .Следствия из закона Гесса.
- •2.2 Энтропия. Второй закон термодинамики.
- •2.3 Энергия Гиббса. Критерии самопроизвольного протекания реакции.
- •Тема 5. Кинетика химических реакций
- •1. Зависимость скорости реакции от концентрации.
- •2. Влияние температуры.
- •Химическое равновесие
- •Где: kр – константа химического равновесия;
- •Модуль 2
- •Змістовний модуль 1
- •Тема № 6
- •Растворы неэлектролитов
- •1. Понятие о растворах. Способы выражения концентрации.
- •2. Свойства растворов неэлектролитов.
- •1.Законы Рауля
- •2. Осмос. Осмотический закон Вант-Гоффа
- •Тема № 7 Растворы электролитов
- •1. Понятия растворов электролитов.
- •2 .Слабые электролиты.
- •Это закон разведения Оствальда
- •3. Сильные электролиты.
- •4. Произведение растворимости.
- •Тема № 8 Гидролиз солей. Обменные реакции в растворах электролитов
- •1. Реакции ионного обмена.
- •2.Гидролиз солей
- •Степень гидролиза(г):
- •3.Влияние различных факторов на смещение равновесия реакций гидролиза.
- •Тема № 9 Дисперсные системы, коллоидные растворы
- •1. Дисперсные системы
- •Классификация дисперсных систем по агрегатному состоянию.
- •2.Коллоидные растворы (золи).
- •2.1 Методы получения коллоидных растворов.
- •2.2 Методы очистки коллоидных систем.
- •2.3 Строение мицеллы.
- •2.4 Устойчивость коллоидных растворов
- •2.5 Седиментация.
- •2.6 Коагуляция и коагуляторы.
- •3. Электрокинетические и оптические свойства коллоидных систем.
- •Тема № 10
- •Ключевые слова и понятия
- •Структура темы:
- •Понятия об окислительно-восстановительных процессах.
- •Зависимость окислительно-восстановительных свойств веществ в зависимости от положения атомов элементов в периодической системе д.И.Менделеева.
- •Важнейшие восстановители и окислители:
- •Змістовний модуль 2
- •Тема № 11.
- •Электродные потенциалы
- •И электродвижущая сила гальванических элементов
- •1. Электроды. Обратимые и необратимые электроды. Электродные потенциалы. Скачки потенциалов на границе фаз.
- •2. Водородный электрод
- •3. Стандартные электродные потенциалы.
- •4. Зависимость электродных потенциалов металлов от температуры и концентрации растворенного вещества. Уравнение Нернста
- •5. Классификация обратимых электродов
- •5.1 Электроды первого рода
- •5.2 Электроды второго рода
- •5.3 Ионоселективные электроды
- •6. Гальванические элементы.
- •6.1 Гальванические элементы с активными электродами
- •6.2 Гальванические элементы с пассивными электродами
- •6.3 Концентрационные гальванические элементы
- •7. Аккумуляторы.
- •Тема 12 Коррозия металлов. Методы защиты металлов от коррозии
- •1.Теоретический материал
- •1.1 Осноовные понятия темы
- •1.2 Методика составления схемы гальванического элемента
- •1.3 Методика расчета электродных потенциалов
- •Тема № 13 Элементы II группы. Кальций, магний и их соединения. Жесткость воды.
- •Входная информация
- •Структура темы:
- •1. Общая характеристика элементов II группы.
- •1.1. Физические свойства элементов II группы. Распространение их в природе.
- •1.2 Получение металлов II группы.
- •1.3 Химические свойства щелочноземельных металлов.
- •2. Соединения щелочноземельных металлов.
- •3. Жесткость воды и методы ее устранения.
- •3.1 Понятие о жесткости воды. Виды жесткости.
- •3.2 Методы устранения жесткости воды.
- •3.3 Методы определения жесткости воды.
- •Тема № 14
- •Структура темы:
- •1. Общая характеристика подгруппы алюминия.
- •2. Общая характеристика алюминия.
- •2.1 Физические свойства алюминия.
- •2.2 Химические свойства алюминия.
- •2.3 Получение и применение алюминия.
- •3. Соединения алюминия.
- •3.1 Оксид алюминия.
- •Разновидности и применение
- •Химические свойства оксида алюминия.
- •Получение оксида алюминия.
- •3.2 Гидроксид алюминия.
- •Химические свойства гидроксида алюминия
- •Получение гидроксида алюминия.
- •3.3 Соли алюминия.
- •4. Применение алюминия и его соединений
- •Тема № 15 Углерод, кремний и их соединения. Ключевые слова и понятия
- •Структура темы:
- •Общие сведения об углероде и кремнии.
- •2. Углерод (с).
- •2.1. Распространение в природе.
- •2.2. Химические свойства углерода.
- •2.3. Основные соединения углерода.
- •Соединения с кислородом:
- •2.3.3. Соли угольной кислоты.
- •3. Кремний (Si).
- •3.1. Распространение в природе.
- •3.2. Получение и применение.
- •3.3. Химические свойства кремния.
- •3.4. Соединения кремния.
- •3.4.1 Оксид кремния (lV) - SiO2
- •3.4.2 Кремниевые кислоты и силикаты.
- •3.4.3. Промышленные силикаты. Стекло.
- •3.4.4. Природные и искусственные силикаты, используемые в строительстве.
- •3. Тематическое содержание § 1. Классификация вяжущих веществ
- •§2. Физико-химические свойства вяжущих веществ
- •§ 2.1 Понятие о дисперсности. Значения степени дисперсности для вяжущих веществ
- •§ 2.2 Пластичность вяжущего теста и пластифицирующие поверхностно-активные добавки
- •§ 2.3 Процессы твердения вяжущих веществ
- •§3. Воздушные вяжущие вещества Воздушные вяжущие вещества (16.2) — известь, гипсовые вяжущие — применялись еще в глубокой древности.
- •§ 3.1 Воздушная известь
- •Получение извести
- •Твердение извести
- •Твердение гипса
- •§ 3.2 Магнезиальные вяжущие. Цемент Сореля. Применение.
- •§6. Стекло. Классификация стекол.
- •4. Критерии усвоения
- •§2. Получения портландцемента
- •§3. Минералогический состав клинкера портландцемента и их характеристика
- •§4. Регулирование сроков схватывания и твердения
- •§5. Гидравлические добавки
- •§6. Глиноземистый цемент
- •§7. Коррозия бетона
- •4. Критерии усвоения
- •5. Выход темы в другие дисциплины
- •Література основна
- •Додаткова література
1.2 Методика составления схемы гальванического элемента
Действие любого гальванического элемента основано на протекании в нем окислительно-восстановительной реакции. В простейшем случае гальваничемкий элемент состоит из двух пластин или стержней, изготовленных из различных металлов и погруженных в раствор электролита. Такая система делает возможным пространственное разделение окислительно-восстановительной реакции: окисление протекает на одном металле, а восстановление – не другом. Таким образом, электроны передаются от восстановителя к окислителю по внешней цепи.
При возникновении гальванической пары появляется электрический ток тем большей силы, чем дальше стоят друг от друга металлы в ряду напряжений. При этом поток электронов идет от более активного металла к менее активному; более активный металл в этом случае разрушается (корродирует).
В качестве примера рассмотрим медно-цинковый гальванический элемент. Этот элемент состоит из медной пластины, погруженной в раствор сульфата меди (медный эелектрод), и цинковой пластины, погруженной в раствор сульфата цинка (цинковый электрод). Оба раствора соприкасаются друг с другом, но для предупреждения смешивания они разделены перегородкой, изготовленной из пористого материала.
Так как цинк является более активным металлом (он расположен в ряду напряжений металло значительно выше меди), то в данном гальваническом элементы он является анодом, а медь – катодом.
При схематическом изображении гальванического элемента граница раздела между металлом и раствором обозначается вертикальной чертой, граница между растворами электролитов – двойной вертикальной чертой.
Схема гальванического элемента будет иметь вид:
(–) Zn│ZnSO4││CuSO4│Cu (+)
или
(–) Zn│Zn2+││Cu2+│Cu (+)
При работе элемента, т.е. при замкнутой цепи, цинк окисляется: на поверхности его соприкосновения с раствором атомы цинка правращаются в ионы и, гидратируясь, переходят в раствор. Этот процесс можно выразить уравнением полуреакции или электрохимическим уравнением:
Zn – 2ē = Zn2+ (реакция на анодном участке)
На медном электроде протекает восстановление ионов меди. Электроны, приходящие сюда от цинкового электрода, соединяются с выходящими из раствора дегидратирующимися ионами меди; образуются атомы меди, выделяющиеся в виде металла.
Cu2+ + 2ē = Cu (реакция на катодном участке)
Суммарное уравнение реакции, протекающей в элементе, получится при сложении уравнений обеих реакций:
Zn + Cu2+ = Zn2+ + Cu
Таким образом, при работе гальванического элемента электроны от восстановителя переходят к окислителю по внешней цепи, на электродах идут электрохимические процессы, в растворе наблюдается направленное движение ионов.
1.3 Методика расчета электродных потенциалов
В соответствии с разделением окислительно-восстановительной реакции на две полуреакции, электродвижущие силы также принято представлять в виде разности двух величин, каждая из которых отвечает данной полуреакции. Эти величины называтся электродными потенциалами (12.6 л).
Как было показано выше, для медно-цинкового элемента реакция, протекающая при его работе Zn + Cu2+ = Zn2+ + Cu
Разбивается на полуреакции:
Zn – 2ē = Zn2+ Cu2+ + 2ē = Cu
Максимальное напряжение гальванического элемента, отвечающее обратимому протеканию происходящей в нем реакции, называется электродвижщей силой Е (ЭДС (12.7 л)) элемента. Если реакция осуществляется в стандартных условиях, т.е., если все вещества, участвующие в реакции, находятся в своих стандартных состояниях, то наблюдаемая при этом ЭДС называется стандартной электродвижущей силой Е0 данного элемента.
ЭДС галванического элемента может быть представлна, как разность двух электродных потенциалов, каждый из которых отвечает полуреакции, протекающей на одном из электродов. Так, для рассмотренного выше медно-цинкового элемента ЭДС выражается разностью:
Е = ЕCu – ЕZn (12.3)
где: ЕCu и ЕZn – потенциалы, отвечающие электродным процессам, происходящим соответственно на медном и цинковом электродах.
При вычислении электродвижущей силы меньший (в алгебраическом смысле) электродный потенциал вычитывается из большего.
Зависимость электродного потенциала от концентраций веществ, участвующих в электродных процессах, и от температуры, выражается уравнением Нернста:
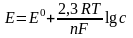 (12.4)
(12.4)
где: Е0 – стандартный электродный потенциал (12.8 л.), В (ряд напряжений металлов);
R – универсальная газовая постоянная (8,314 Дж/мольК);
T – абсолютная температура, К;
F – постоянная Фарадея (96500 Кл/моль);
n – число электронов, участвующих в электродном процессе;
c – концентрация электролита, моль/л.
После подстановки в уравнение (12.4) значений R, T, F оно приобретает для 25ºС (298 К) следующий вид:
 (12.5)
(12.5)
Чтобы определить ЭДС элемента, необходимо вычислить электродные потенциалы. Для этого из ряда напряжений металлов (справочные материалы по химии) находим значения стандартных электродных потенциалов систем Zn2+/Zn (–0,763В) и Cu2+/Cu (0,337В), а затем рассчитываем значения Е по уравнению Нернста:


Таким образом, для медно-цинкового гальванического элемента его ЭДС при концентрации растворов электролитов 0,1М будет равно:
Е = ЕCu – ЕZn = 0,3075 – (-0,7925) = 1,1В
В качестве электрода сравнения, стандартный потенциал которого считается равным нулю, принят стандартный электродный потенциал, на котором осуществляется процесс:
2Н+ + 2ē = Н2
При 25ºС потенциал водородного электрода определяется выражением:
Е = –0,059рН
где: рН – это мера активности (в случае разбавленных растворов совпадает с концентрацией) ионов водорода в растворе, количественно выражающая его кислотность, вычисляется как отрицательный десятичный логарифм концентрации водородных ионов, выраженной в молях на литр: рН = –lg [Н+].
Например, в нейтральных растворах (рН = 7) Е = –0,059 · 7≈-0,41В.
