
- •Міністерство освіти і науки України Донбаська національна академія будівництва і архітектури
- •Конспект лекцій
- •101 «Екологія», 133 «Галузеве машинобудування»,
- •192 «Будівництво та цивільна інженерія», 274 «Автомобільний транспорт»
- •Тема 2 Періодичний закон та періодична система д.І.Менделєєва……………………..15
- •1. Научные открытия, подтвердившие сложность строения атомов
- •Шрёдингер Эрвин
- •3. Квантовые числа
- •4. Строение многоэлектронных атомов
- •Гунд Фридрих
- •Паули Вольфганг
- •4.2 Правило Гунда
- •Тема № 2 _Периодический закон и периодическая система д.И.Мендилеева
- •Формулировка и физический смысл периодического закона.
- •Зависимость от положения в периодической системе энергии ионизации, сродства к электрону, относительной электроотрицательности.
- •4.Седения об элементах, получаемые из таблицы д.И.Менделеева.
- •-Высшую и низшую степени окисления элемента. Тема № 3 _Химическая связь
- •Химическая связь. Ее характеристики
- •3. Типы химической связи:
- •3. Квантово-химические методы описания химической связи.
- •Тема № 4 _Химическая термодинамика
- •Введение в химическую термодинамику.
- •1.1 Основные понятия термохимии.
- •1.2 Первый закон термодинамики для различных процессов.
- •2.Термодинамические функции состояния.
- •2.1.Энтальпия. Закон Гесса.
- •Закон Гесса .Следствия из закона Гесса.
- •2.2 Энтропия. Второй закон термодинамики.
- •2.3 Энергия Гиббса. Критерии самопроизвольного протекания реакции.
- •Тема 5. Кинетика химических реакций
- •1. Зависимость скорости реакции от концентрации.
- •2. Влияние температуры.
- •Химическое равновесие
- •Где: kр – константа химического равновесия;
- •Модуль 2
- •Змістовний модуль 1
- •Тема № 6
- •Растворы неэлектролитов
- •1. Понятие о растворах. Способы выражения концентрации.
- •2. Свойства растворов неэлектролитов.
- •1.Законы Рауля
- •2. Осмос. Осмотический закон Вант-Гоффа
- •Тема № 7 Растворы электролитов
- •1. Понятия растворов электролитов.
- •2 .Слабые электролиты.
- •Это закон разведения Оствальда
- •3. Сильные электролиты.
- •4. Произведение растворимости.
- •Тема № 8 Гидролиз солей. Обменные реакции в растворах электролитов
- •1. Реакции ионного обмена.
- •2.Гидролиз солей
- •Степень гидролиза(г):
- •3.Влияние различных факторов на смещение равновесия реакций гидролиза.
- •Тема № 9 Дисперсные системы, коллоидные растворы
- •1. Дисперсные системы
- •Классификация дисперсных систем по агрегатному состоянию.
- •2.Коллоидные растворы (золи).
- •2.1 Методы получения коллоидных растворов.
- •2.2 Методы очистки коллоидных систем.
- •2.3 Строение мицеллы.
- •2.4 Устойчивость коллоидных растворов
- •2.5 Седиментация.
- •2.6 Коагуляция и коагуляторы.
- •3. Электрокинетические и оптические свойства коллоидных систем.
- •Тема № 10
- •Ключевые слова и понятия
- •Структура темы:
- •Понятия об окислительно-восстановительных процессах.
- •Зависимость окислительно-восстановительных свойств веществ в зависимости от положения атомов элементов в периодической системе д.И.Менделеева.
- •Важнейшие восстановители и окислители:
- •Змістовний модуль 2
- •Тема № 11.
- •Электродные потенциалы
- •И электродвижущая сила гальванических элементов
- •1. Электроды. Обратимые и необратимые электроды. Электродные потенциалы. Скачки потенциалов на границе фаз.
- •2. Водородный электрод
- •3. Стандартные электродные потенциалы.
- •4. Зависимость электродных потенциалов металлов от температуры и концентрации растворенного вещества. Уравнение Нернста
- •5. Классификация обратимых электродов
- •5.1 Электроды первого рода
- •5.2 Электроды второго рода
- •5.3 Ионоселективные электроды
- •6. Гальванические элементы.
- •6.1 Гальванические элементы с активными электродами
- •6.2 Гальванические элементы с пассивными электродами
- •6.3 Концентрационные гальванические элементы
- •7. Аккумуляторы.
- •Тема 12 Коррозия металлов. Методы защиты металлов от коррозии
- •1.Теоретический материал
- •1.1 Осноовные понятия темы
- •1.2 Методика составления схемы гальванического элемента
- •1.3 Методика расчета электродных потенциалов
- •Тема № 13 Элементы II группы. Кальций, магний и их соединения. Жесткость воды.
- •Входная информация
- •Структура темы:
- •1. Общая характеристика элементов II группы.
- •1.1. Физические свойства элементов II группы. Распространение их в природе.
- •1.2 Получение металлов II группы.
- •1.3 Химические свойства щелочноземельных металлов.
- •2. Соединения щелочноземельных металлов.
- •3. Жесткость воды и методы ее устранения.
- •3.1 Понятие о жесткости воды. Виды жесткости.
- •3.2 Методы устранения жесткости воды.
- •3.3 Методы определения жесткости воды.
- •Тема № 14
- •Структура темы:
- •1. Общая характеристика подгруппы алюминия.
- •2. Общая характеристика алюминия.
- •2.1 Физические свойства алюминия.
- •2.2 Химические свойства алюминия.
- •2.3 Получение и применение алюминия.
- •3. Соединения алюминия.
- •3.1 Оксид алюминия.
- •Разновидности и применение
- •Химические свойства оксида алюминия.
- •Получение оксида алюминия.
- •3.2 Гидроксид алюминия.
- •Химические свойства гидроксида алюминия
- •Получение гидроксида алюминия.
- •3.3 Соли алюминия.
- •4. Применение алюминия и его соединений
- •Тема № 15 Углерод, кремний и их соединения. Ключевые слова и понятия
- •Структура темы:
- •Общие сведения об углероде и кремнии.
- •2. Углерод (с).
- •2.1. Распространение в природе.
- •2.2. Химические свойства углерода.
- •2.3. Основные соединения углерода.
- •Соединения с кислородом:
- •2.3.3. Соли угольной кислоты.
- •3. Кремний (Si).
- •3.1. Распространение в природе.
- •3.2. Получение и применение.
- •3.3. Химические свойства кремния.
- •3.4. Соединения кремния.
- •3.4.1 Оксид кремния (lV) - SiO2
- •3.4.2 Кремниевые кислоты и силикаты.
- •3.4.3. Промышленные силикаты. Стекло.
- •3.4.4. Природные и искусственные силикаты, используемые в строительстве.
- •3. Тематическое содержание § 1. Классификация вяжущих веществ
- •§2. Физико-химические свойства вяжущих веществ
- •§ 2.1 Понятие о дисперсности. Значения степени дисперсности для вяжущих веществ
- •§ 2.2 Пластичность вяжущего теста и пластифицирующие поверхностно-активные добавки
- •§ 2.3 Процессы твердения вяжущих веществ
- •§3. Воздушные вяжущие вещества Воздушные вяжущие вещества (16.2) — известь, гипсовые вяжущие — применялись еще в глубокой древности.
- •§ 3.1 Воздушная известь
- •Получение извести
- •Твердение извести
- •Твердение гипса
- •§ 3.2 Магнезиальные вяжущие. Цемент Сореля. Применение.
- •§6. Стекло. Классификация стекол.
- •4. Критерии усвоения
- •§2. Получения портландцемента
- •§3. Минералогический состав клинкера портландцемента и их характеристика
- •§4. Регулирование сроков схватывания и твердения
- •§5. Гидравлические добавки
- •§6. Глиноземистый цемент
- •§7. Коррозия бетона
- •4. Критерии усвоения
- •5. Выход темы в другие дисциплины
- •Література основна
- •Додаткова література
Шрёдингер Эрвин
Ш Австрийский физик-теоретик. Один из создателей квантовой механики. Исходя из теории Л. де Бройля о корпускулярно-волновом дуализме, разработал теорию движения микрочастиц – волновую механику, в основу которой положил введенное им (1926) волновое уравнение. Это уравнение является фундаментальным для квантовой химии. Нобелевская премия по физике (1933, совместно с П. Дираком). |
Австрийский ученый Шредингер утверждает, что состояние движущего электрона в атомной системе можно описать уравнением стоячей электромагнитной волны, в которой ψ отвечает амплитуде волнового процесса в трехмерном пространстве: ψ (х,у,z). В простейшем случае уравнение Шредингера может быть записано в следующей форме:
-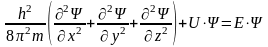 ,
,
где
 -
масса частицы;
-
масса частицы;
U-потенциальная энергия ;
E - полная энергия;
x,y,z -координаты.
Волновая функция ψ характеризует амплитуду волны в зависимости от координат электрона, а ее квадрат ψ2 определяет пространственное распределение электрона в атоме (1.3) и называется плотностью вероятности.
Плотность вероятности (1.4)- это квадрат волновой функции, которая дает представление об электроне, как об электронном облаке или его орбиталь. |
Таким образом, атомная орбиталь (АО) – область пространства вокруг ядра атома, в котором наиболее вероятно пребывание электрона.
Атомная орбиталь (1.5) – область пространства вокруг ядра атома, в котором наиболее вероятно пребывание электрона. |
3. Квантовые числа
Атомные орбитали электрона, их энергия и направление в пространстве зависят от параметров – квантовых чисел, которые являются следствием решения уравнения Шредингера, характеризующих поведение электрона в атоме любого элемента.
3.1 Главное квантовое число
Главное квантовое число (n) определяет общую энергию электрона в границах определенной орбитали и среднюю радиальную отдаленность электронной плотности от ядра или размеры электронных облаков. В этом случае энергия электрона равна:
|
где n принимает значения от 1 до ∞.
Энергия электрона может принимать только определенные значения, т.е. она квантована. Чем меньше n, тем больше энергия взаимодействия электрона с ядром.
Состояния электрона, характеризующиеся определенным значением главного квантового числа, принято называть энергетическим уровнем электрона в атоме.
Энергетический уровень – это положение электрона в атоме, отвечающее определенному запасу энергии.
Энергетический уровень (1.6) – это положение электрона в атоме, отвечающее определенному запасу энергии. |

Рис.1- Энергетические уровни атома водорода.
Значения главного квантового числа n, отвечающие уровням 1, 2, 3, 4, 5, 6, 7…, в многоэлектронных атомах обозначаются буквами K, L, M, N, O, P и Q. Буква K соответствует первому уровню, L – второму и т. д. Значения главного квантового числа определяют размеры электронного облака, то есть показывают, число энергетических подуровней на данном уровне.
Энергетический подуровень - характеризует относительный запас энергии электрона на подуровнях, из которых состоят энергетические уровни.
Энергетический подуровень(1.7) - характеризует относительный запас энергии электрона на подуровнях, из которых состоят энергетические уровни. |
Для уровня K главное квантовое число n равняется 1, т.е. этот уровень состоит из одного подуровня (1.7); уровень L (n=2) состоит из двух подуровней; уровень M (n=3) состоит из трех подуровней; уровень N (n=4) состоит из четырех подуровней и т.д. Для описания строения атомов химических элементов достаточно только четырех подуровней и на остальных уровнях.
3.2 Орбитальное квантовое число
Орбитальное (побочное или азимутальное) квантовое число l согласно квантово – механическим расчетам определяет не только размеры подуровня, но и характеризует форму орбиталей и принимает значения от 0 до (n – 1): 0, 1, 2, 3, 4... , что также подтверждает дискретность(1.2) энергии. Кроме числовых значений l имеет буквенные обозначения :
l |
= |
0 |
1 |
2 |
3 |
4 |
… |
l |
= |
s |
p |
d |
f |
g |
… |
Совокупность электронов с одинаковым значением l представляют собой электронный подуровень.
При l=0 электронные облака имеют сферическую (шаровую) симметрию, а электроны называются s-электронами.
При l=1 электронные облака имеют форму гантели (объемная восьмерка), а электроны называются p-электронами.
При l=2 электронные облака имеют сложную форму «сдвоенных» гантелей, а электроны называются d-электронами.
При l=3 электронные облака имеют еще более сложную конфигурацию гантелей, а электроны называются f-электронами.
Для описания электронного строения атомов известных сегодня элементов достаточно s-, p-, d-, f-подуровней.
3.3 Магнитное квантовое число
Из решения уравнения Шредингера следует, что электронные облака ориентированы определенным образом в пространстве. Пространственная ориентация определяется магнитным квантовым числом ml, которое характеризует момент количества движения электрона на какую-либо ось координат. Число значений магнитного квантового числа равно:
ml = 2 l +1.
Оно определяет пространственное расположение атомной орбитали и принимает целые значения от –l до +l через нуль, то есть 2l + 1 значений.
Для l=0, ml = 0 и s-подуровень имеет только одну ориентацию в пространстве:

Для l=1, ml = -1,0,+1 и p -подуровень имеет три ориентации в пространстве по осям координат:

Для l=2 ml = -2,-1,0,+1,+2 и d -подуровень имеет соответственно пять ориентаций в пространстве:

Для l=3 ml =-3,-2,-1,0,+1,+2, +3 и f -подуровень имеет уже семь ориентаций в пространстве:


Все вышесказанное можно представить таблицей:
|
||||||||||||||||||
Таблица 1 - Число орбиталей на энергетических подуровнях |
Орбитали одного подуровня (l = const) имеют одинаковую энергию. Такое состояние называют вырожденным по энергии. Так p-орбиталь – трехкратно, d – пятикратно, а f – семикратно вырождены.
Граничные поверхности s-, p-, d-, f- орбиталей показаны выше рисунками.
Квантовые числа n, l и ml не полностью характеризуют состояние электрона в атоме. Экспериментально установленно, что электрон имеет еще одно свойство – спин. Упрощенно спин можно представить как вращение электрона вокруг собственной оси.
Спиновое
квантовое число ms
имеет только два значения ms
= ±1/2, представляющие собой две проекции
углового момента электрона на выделенную
ось. Электроны с разными ms
обозначаются стрелками, направленными
вверх
![]() и
вниз
и
вниз
![]() .
.
Итак, четыре квантовых числа описывают состояние электрона в атоме и характеризуют энергию электрона, его спин, форму электронного облака и его ориентацию в пространстве. При переходе атома из одного состояния в другое происходит перестройка электронного облака, то есть изменяются значения квантовых чисел, что сопровождается поглощением или испусканием атомом квантов энергии.
Три квантовых числа (главное, орбитальное и магнитное) показывают форму, пространственное расположение и относительный запас энергии электрона на атомной орбитали (1.5). Для схематического изображения атомных орбиталей принимается условное их изображение в виде клетки, которое принято называть квантовой ячейкой.
Квантовая ячейка (1.8) - схематического изображения атомной орбитали. |
К![]() ак
следует из таблицы 1, каждый подуровень(1.7)
представляет
определенное число атомных орбиталей:
ак
следует из таблицы 1, каждый подуровень(1.7)
представляет
определенное число атомных орбиталей:
s- подуровень – 1, условное изображение
![]()
p- подуровень – 3, условное изображение
![]()
d- подуровень - 5, условное изображение
![]()
f- подуровень - 7, условное изображение

 рёдингер
Эрвин (12.VIII.1887–4.I.1961)
рёдингер
Эрвин (12.VIII.1887–4.I.1961)