
Олимпиада по химии. 9 класс. 2016-2017 учебный год.
Всероссийская олимпиада школьников по химии 2016-2017год
II (муниципальный этап), 9 класс Решения
1. При взаимодействии 3,6 г простого вещества, образованного элементом Э, с кислородом образовался оксид элемента (IV) и выделилось 117,9 кДж теплоты. Определите молекулярную формулу оксида элемента (IV), назовите его. Теплота образования оксида элемента (IV) равна 393 кДж/моль. Образовавшийся оксид полностью взаимодействует с 164,45 г 14,6%-го раствора гидроксида натрия с образованием насыщенного при 20оС раствора соли. Вычислите массовую долю соли в растворе и ее растворимость в воде (в г/л, ответ округлите до целого числа). (10 баллов)
0,3 Моль 0,3 моль
Э + О2 = ЭО2 1 балл
1 моль 1 моль 1 моль
х г/моль
ν(Э) = ν(ЭО2) = 117,9 кДж / 393 кДж/моль = 0,3 моль 1 балл
0,3 = 3,6 / х
х = 12 → С, СО2 – углекислый газ, оксид углерода (IV), ангидрид угольной кислоты
1 балл
ν(NaОН) = (164,45 ∙ 0,146) / 40 г/моль = 0,6 моль 1 балл
ν(СО2) : ν(NaОН) = 0,3 моль : 0,6 моль = 1 : 2 → образуется средняя соль Na2СO3
1 балл
0,3 моль 0,6 моль 0,3 моль
СO2 + 2NaОН = Na2СO3 + H2O 2 балла
1 моль 2 моль 1 моль
44 г/моль 106 г/моль
m(раствора Na2СO3) = m(CO2) + m(раствора NaOH) m(раствора Na2СO3) = 0,3 моль ∙ 44 г/моль + 164,45 г = 177,65 г 1 балл ω%(Na2СO3) = ((0,3 моль ∙ 106 г/моль / 177,65 г) ∙ 100% = 17,9% 1 балл
ω%(H2O) = 100% - 17,9% = 82,1%
S20(Na2СO3) = (17,9 г / 82,1 г) ∙ 1000 = 218 г/л 1 балл
или
m(Na2СO3) = 0,3 моль ∙ 106 г/моль = 31,8 г
m(H2O) = 177,65 г – 31,8 г = 145,85 г V(H2O) = 0,14585 л
S20(Na2СO3) = (31,8 г / 145,85 г) ∙ 1000 = 218 г/л
S20(Na2СO3) = 31,8 г / 0,14585 л = 218 г/л
10 Баллов
2. Оксид металла содержит 80,2469% металла по массе. Определите молекулярную формулу оксида, назовите его. Напишите уравнения реакций (молекулярные, ионные и окислительно-восстановительные), с помощью которых можно осуществить превращения с данным оксидом и соединениями металла:
1 2 3 4 5 6 7
Me2On→Me→Me(NO3)n→Me2On→MeCln→Me(OH)n-(+ KOHконц.)→Х1→Me2(SO4)n
↓8
Х1 (13 баллов)
Ме2Оn → 2Me 1 балл
1моль 2 моль
(2х + 16n) г/моль х г/моль
0,802469 = 2х / (2х + 16n)
(2х + 16n) = 2,4923х
0,4923х = 16n
x = 32,5n 1 балл
n = 1 → x = 32,5 ─
n = 2 → x = 65 → Zn, ZnO - оксид цинка 1 балл
1. ZnO + H2 = Zn + H2O (toC) (OBP) 1 балл
или
ZnO + C = Zn + CO↑ (toC) (OBP)
ZnO + CО = Zn + CO2↑ (toC) (OBP)
3ZnO + 2NH3(г) = 3Zn + N2↑ + 3H2O (toC) (OBP)
3ZnO + 2Al = 3Zn + Al2O3 (toC) (OBP)
2ZnO + ZnS = 3Zn + SO2↑ (toC) (OBP)
2. 4Zn + 10HNO3 очень разб. = 4Zn(NO3)2 + NH4NO3 + 3H2O (OBP) 1 балл
или
5Zn + 12HNO3 разб. = 5Zn(NO3)2 + N2↑ + 6H2O (OBP)
4Zn + 10HNO3 разб. = 4Zn(NO3)2 + N2O↑ + 5H2O (OBP)
3Zn + 8HNO3 разб. = 3Zn(NO3)2 + 2NO↑ + 4H2O (OBP)
Zn + 4HNO3 конц. = Zn(NO3)2 + 2NO2↑ + 2H2O (OBP)
Zn + Pb(NO3)2 = Zn(NO3)2 + Pb↓ (OBP) (Cu(NO3)2, Hg(NO3)2, AgNO3)
+5 –2 –2 +4 –2 0
3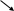
 .
2Zn(NO3)2
= 2ZnO + 4NO2↑
+ O2↑
(toC)
(ОВР) 1
балл
.
2Zn(NO3)2
= 2ZnO + 4NO2↑
+ O2↑
(toC)
(ОВР) 1
балл
1e∙2/2 2e∙2/1 ок-е, вос-ль
вос-е, ок-ль
4. ZnO + 2HCl = ZnCl2 + H2O 1 балл
ZnO + 2H+ = Zn2+ + H2O
или
ZnO + C + Cl2 = ZnCl2 + CO↑ (OBP)
5. ZnCl2 + 2KOH = Zn(OH)2↓ + 2KCl (NaOH, Ca(OH)2) 1 балл
Zn2+ + 2OH- = Zn(OH)2↓
или
ZnCl2 + 2NH3 + 2H2O = Zn(OH)2↓ + 2NH4Cl
Zn2+ + 2NH3 + 2H2O = Zn(OH)2↓ + 2NH4+
6. Zn(OH)2 + 2KOH = K2[Zn(OH)4] 2 балла
Zn(OH)2 + 2OH- = [Zn(OH)4]2-
7. K2[Zn(OH)4] + 2H2SO4 = ZnSO4 + K2SO4 + 4H2O 1 балл
[Zn(OH)4]2- + 4H+ = Zn2+ + 4H2O
8. Zn + 2KOH+ 2H2O = K2[Zn(OH)4] +Н2↑(ОВР) 2 балла
