
- •(Для иностранных студентов)
- •Содержание Введение
- •Введение
- •Технологическая схема
- •1 Основные типы химических реакций в синтезе лекарственных веществ
- •1.1 Процессы галогенирования
- •Реакции галогенирования
- •Основные стадии процесса хлорирования
- •Процессы фторирования
- •Фторирование молекулярным фтором и высшими фторидами металлов
- •Технология фторирования
- •Техника безопасности
- •1.2 Процессы сульфирования и сульфохлорирования
- •Механизм реакции сульфирования
- •Основные способы сульфирования
- •Техника безопасности при проведении сульфирования и сульфохлорирования
- •1.3 Процессы нитрования
- •Условия проведения процессов нитрования
- •Способы нитрования
- •Нитрование бензола
- •Техника безопасности
- •1.4 Процессы восстановления
- •Восстановление металлами
- •Восстановление сульфидами щелочных металлов
- •Каталитическое восстановление водородом
- •Электролитическое восстановление
- •Техника безопасности
- •1.5 Процессы окисления
- •Характеристика процессов окисления
- •Окислительные агенты
- •Реакции окисления с сохранением углеродного скелета молекулы
- •Аппаратурная схема синтеза изовалериановой кислоты
- •Получение хинонов и кетонов
- •Реакции окисления с изменением углеродного скелета молекулы. Получение дикарбоновых кислот
- •Получение гидроксисоединений
- •Гетерогенно-каталитическое окисление в паровой фазе
- •Гетерогенные катализаторы
- •Реакторы процессов гетерогенно-каталитического окисления
- •Окисление олефинов по насыщенному атому углерода. Производство акролеина
- •Техника безопасности
- •1.6 Процессы диазотирования и нитрозирования
- •Механизм реакции диазотирования
- •Условия проведения процесса
- •Превращение диазосоединений
- •Производство гваякола
- •Техника безопасности
- •1.7 Процессы алкилирования
- •Продукты алкилирования
- •Алкилирующие средства
- •Алкилирование аминов
- •Алкирование простыми эфирами
- •Алкирование сложными эфирами
- •Алкилирование галогеналкилами
- •Алкилирование ароматических оксисоединений
- •Алкилирование углеводородного радикала
- •1.8 Процессы ацилирования
- •Ацилирующие средства
- •Ацилирование аминогруппы
- •Ацилирование оксигруппы в ароматических соединениях
- •1.9 Конденсации по карбонильной группе
- •Конденсации по карбонильной группе с ароматическими соединениями
- •Получение диаминофенилметанов
- •Получение ддт
- •Реакция хлорметилирования
- •Синтез ацеталей
- •Реакция Принса
- •Конденсация альдегидов и кетонов с азотистыми основаниями
- •Реакции типа альдольной конденсации
Технологическая схема

Технологическая схема до некоторой степени определяет аппаратурное оформление производственного процесса. Однако окончательное представление об оборудовании производства можно получить лишь из аппаратурной схемы, которая указывает не только типы устанавливаемого оборудования, но и его относительное высотное расположение, степень использования самотека, способ подачи сырья и материалов.
Характерной чертой технологических методов получения полупродуктов является наличие одной основной химической реакции для перехода от сырья или от одного полупродукта к следующему, а также общность методов проведения этих реакций для различных видов сырья. При изучении технологии синтетических лекарственных веществ целесообразно сначала рассмотреть методы получения полупродуктов, при которых в исходную молекулу сырья вводятся отдельные атомы или группы атомов, а затем методы, вносящие изменения в функциональные группы органических соединений и, в конце концов, методы, приводящие к изменению скелета молекулы продукта.
Поэтому общие методы получения полупродуктов рассмотрим в такой последовательности:
1. Галогенирование
2. Сульфирование
3. Нитрование
4. Восстановление
5. Окисление
6. Диазотирование
7. Алкилирование
8. Ацилирование
9. Конденсации.
1 Основные типы химических реакций в синтезе лекарственных веществ
1.1 Процессы галогенирования
Галогенированием называется процесс введения галогена в молекулу органического вещества. В зависимости от вводимого галогена этот тип реакций называется соответственно фторированием, хлорированием, бромированием и йодированием.
Галогенпроизводные являются биологически активными веществами. Галогенпроизводные алифатического ряда обладают наркотическими свойствами, а ароматического – проявляют антимикробные свойства. Они все токсичны. Токсичность увеличивается с увеличением числа атомов галогена в молекуле соединения, поэтому такие соединения используются при получении препаратов для борьбы с вредителями сельского хозяйства.
Галогенопроизводные применяются и в качестве лекарственных средств (хлороформ, йодоформ), но главным образом их используют как полупродукты для синтеза различных химфармпрепаратов, не содержащих галоген. Здесь галоген участвует лишь в промежуточных реакциях.
С повышением порядкового номера галогена процесс галогенирования постепенно затрудняется. Так, если фтор реагирует с предельными углеводородами взрывообразно, а хлор достаточно энергично, то бром действует значительно слабее, а йод практически совсем не вступает в реакцию.
Фтор реагирует с органическими веществами слишком энергично. Поэтому он может применяться, только будучи разбавленным каким-либо инертным газом или в среде инертного растворителя (ССl4). Фтор образует очень прочные соединения, поэтому не находит применения в технологии полупродуктов, но используется в других отраслях промышленности. Так дифтордихлорметан CF2Cl2 – фреон-12 применяется как хладагент в холодильных машинах. Широкое применение находят перфторуглероды, они образуются из предельных углеводородов путем замещения всех атомов водорода фтором. Это высокопрочные соединения, выдерживающие нагревание до 5000С без разложения. Они применяются в качестве инертных растворителей, синтетических пластмасс (фторопласты), диэлектриков.
Таким образом, наиболее прочными и наименее реакционно-способными полупродуктами являются хлорпроизводные, активнее их бромопроизводные и наиболее реакционно-способные и непрочные – йодопроизводные.
Наиболее часто в технологии полупродуктов используются хлорпроизводные. Это объясняется тем, что хоть хлорпроизводные и наименее реакционно-способные полупродукты, но введение хлора, активно реагирующего с органическими соединениями, удобнее, дешевле и доступнее любого другого. Кроме того, хлорпроизводные часто являются достаточно реакционно-способными. Бром и йод используют лишь в особых случаях и когда они должны присутствовать в конечном продукте.
В технологии химфармпрепаратов чаще всего применяются такие галогенирующие средства:
М олекулярный
хлор. В отсутствие влаги хлор с железом
не реагирует, поэтому его хранят и
транспортируют в стальных баллонах (10
и 20 л) и цистернах в жидком состоянии
под давлением. Наиболее энергично
реагирует атомарный хлор в момент
выделения. Его получают окислением
хлористого водорода с помощью перманганата
калия в кислой среде:
олекулярный
хлор. В отсутствие влаги хлор с железом
не реагирует, поэтому его хранят и
транспортируют в стальных баллонах (10
и 20 л) и цистернах в жидком состоянии
под давлением. Наиболее энергично
реагирует атомарный хлор в момент
выделения. Его получают окислением
хлористого водорода с помощью перманганата
калия в кислой среде:
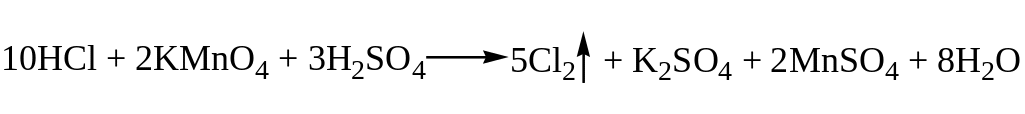 Применяется
молекулярный хлор обычно для замещения
атомов водорода в алифатических радикалах
или в ароматическом цикле, а также для
присоединения к ненасыщенным алифатическим
углеводородам
Применяется
молекулярный хлор обычно для замещения
атомов водорода в алифатических радикалах
или в ароматическом цикле, а также для
присоединения к ненасыщенным алифатическим
углеводородам
RHx
+ xCl2
RClx
+
xHCl
(замещение)

(присоединение)
Получающаяся по окончании хлорирования масса оказывается насыщенной хлористым водородом и не вступившим в реакцию хлором. Для их удаления обычно применяют продувку реакционной массы воздухом. Для быстрого снятия избытка хлора в реакционную массу пропускают сернистый газ или добавляют бисульфит натрия
 .
.

Хлористый водород HCl. Как в газообразном состоянии, так и в форме водного раствора (соляная кислота) или раствора в органическом растворителе он применяется для введения хлора на место спиртового гидроксила
![]()
для присоединения к ненасыщенным алифатическим соединениям (гидрохлорирование)

а также для получения солянокислых солей (хлоргидратов) органических веществ основного характера. С парафинами и ароматическими углеводородами он не реагирует.
Треххлористый фосфор PCl3 применяется в безводных условиях (полная сухость реактивов и аппаратуры) для введения хлора на место кислотного гидроксила, то есть для получения хлорангидридов органических кислот, в основном низших.

Пятихлористый фосфор PCl5 также используется для получения хлорангидридов кислот:
RCOOH + PCl5 RCOCl + POCl3 + HCl
Водой он разлагается последовательно с образованием сначала POCl3, а затем ортофосфорной кислоты:
PCl5 + H2O POCl3 + 2HCl
POCl3 + 3H2O PO(OH)3 + 3HCl
Хлорокись фосфора POCl3 в безводной среде служит тем же целям, что и PCl3, однако действует энергичнее и поэтому используется для получения хлорангидридов более сложных (высокомолекулярных) кислот.
Галогениды фосфора неудобны тем, что реакционная смесь загрязняется нелетучими фосфорными кислотами.
Этого недостатка нет у тионила хлористого SOCl2, который используется, как и POCl3, однако образует лишь газообразные продукты (HCl и SO2), легко удаляемые из реакционной массы. Поэтому он также применяется в органическом синтезе для удаления следов влаги в реакционной массе и для дегидратирования органических соединений.
![]()
Со спиртами и фенолами он образует сложные эфиры сернистой кислоты:

Все перечисленные хлорангидрирующие средства растворимы без разложения в безводных органических растворителях, не содержащих окси– и аминогрупп: бензоле, толуоле, дихлорэтане, хлороформе, четыреххлористом углероде. Хранят и транспортируют жидкие галогениды фосфора и SOCl2 в стеклянных бутылях или освинцованных бочках.
Фосген COCl2 (хлорангидрид угольной кислоты) очень ядовитый тяжелый газ, используется для получения хлорангидридов кислот, а также применяется в многочисленных синтезах, где могут участвовать в реакциях как один, так и оба атома хлора. Фосген образует лишь газообразные побочные продукты реакции:

Хранят и транспортируют фосген в сжиженном состоянии в стальных баллонах.
Хлорсульфоновая кислота HO-SO2Cl (хлористый сульфонил) - неполный хлорангидрид серной кислоты – тяжелая жидкость, дымится на воздухе:

Она применяется для прямого получения хлорангидридов ароматических сульфокислот ArSО2Cl
![]()
а также хлорангидридов органических кислот, как и другие хлорангидрирующие средства.
Хлорсульфоновая кислота не реагирует с железом, поэтому ее хранят и транспортируют в стальных бочках.
Для введения брома в органическую молекулу применяют следующие средства: молекулярный бром, бромистый водород, трехбромистый и пятибромистый фосфор. Их применяют в тех же случаях, что и соответствующие соединения хлора.
