
- •(Для иностранных студентов)
- •Содержание Введение
- •Введение
- •Технологическая схема
- •1 Основные типы химических реакций в синтезе лекарственных веществ
- •1.1 Процессы галогенирования
- •Реакции галогенирования
- •Основные стадии процесса хлорирования
- •Процессы фторирования
- •Фторирование молекулярным фтором и высшими фторидами металлов
- •Технология фторирования
- •Техника безопасности
- •1.2 Процессы сульфирования и сульфохлорирования
- •Механизм реакции сульфирования
- •Основные способы сульфирования
- •Техника безопасности при проведении сульфирования и сульфохлорирования
- •1.3 Процессы нитрования
- •Условия проведения процессов нитрования
- •Способы нитрования
- •Нитрование бензола
- •Техника безопасности
- •1.4 Процессы восстановления
- •Восстановление металлами
- •Восстановление сульфидами щелочных металлов
- •Каталитическое восстановление водородом
- •Электролитическое восстановление
- •Техника безопасности
- •1.5 Процессы окисления
- •Характеристика процессов окисления
- •Окислительные агенты
- •Реакции окисления с сохранением углеродного скелета молекулы
- •Аппаратурная схема синтеза изовалериановой кислоты
- •Получение хинонов и кетонов
- •Реакции окисления с изменением углеродного скелета молекулы. Получение дикарбоновых кислот
- •Получение гидроксисоединений
- •Гетерогенно-каталитическое окисление в паровой фазе
- •Гетерогенные катализаторы
- •Реакторы процессов гетерогенно-каталитического окисления
- •Окисление олефинов по насыщенному атому углерода. Производство акролеина
- •Техника безопасности
- •1.6 Процессы диазотирования и нитрозирования
- •Механизм реакции диазотирования
- •Условия проведения процесса
- •Превращение диазосоединений
- •Производство гваякола
- •Техника безопасности
- •1.7 Процессы алкилирования
- •Продукты алкилирования
- •Алкилирующие средства
- •Алкилирование аминов
- •Алкирование простыми эфирами
- •Алкирование сложными эфирами
- •Алкилирование галогеналкилами
- •Алкилирование ароматических оксисоединений
- •Алкилирование углеводородного радикала
- •1.8 Процессы ацилирования
- •Ацилирующие средства
- •Ацилирование аминогруппы
- •Ацилирование оксигруппы в ароматических соединениях
- •1.9 Конденсации по карбонильной группе
- •Конденсации по карбонильной группе с ароматическими соединениями
- •Получение диаминофенилметанов
- •Получение ддт
- •Реакция хлорметилирования
- •Синтез ацеталей
- •Реакция Принса
- •Конденсация альдегидов и кетонов с азотистыми основаниями
- •Реакции типа альдольной конденсации
Техника безопасности
Все ароматические нитросоединения ядовиты. Динитросоединения, кроме того, вызывают раздражение кожи, дерматиты и экземы. Нитросоединения пожароопасны, а динитропродукты еще и взрывоопасны.
Основной способ защиты – полная герметизация оборудования. Нельзя смешивать жидкости, в результате чего образуются ядовитые вещества. При вдыхании окислов азота может наступить отек легких со смертельным исходом. Накопление азотной кислоты в нитраторе может привести к хлопкам, выбросам и даже взрывам. Для этого блокируют подачу нитрующей смеси с мешалкой и регулятором температуры.
Все аппараты, где выделяются окислы азоты нужно оборудовать вентиляцией.
Непрерывное ведение процесса нитрования обеспечивает безопасность из-за снижения концентрации азотной кислоты в реакционной массе.
При высоких температурах нитропродукты и кубовые жидкости после их перегонки могут самопроизвольно разлагаться, а при попадании в них воздуха – и взрываться. Чтобы это предотвратить, воздух из аппаратов вытесняют инертным газом.
В цехах работают в спецодежде при включенной приточной и вытяжной вентиляции. После работы следует обязательно мыться.
Признаки отравления нитросоединениями – посинение губ, носа, ушей, кончиков пальцев, головная боль, головокружение, тошнота.
1.4 Процессы восстановления
Восстановление и окисление – неразрывно связанные между собой реакции. Если одно из веществ, участвующих в реакции окисляется, то другое восстанавливается. Поэтому название реакции обычно связано с получением целевого продукта.
Многочисленные методы восстановления и окисления можно разделить на 4 группы: химические, каталитические, электролитические и биохимические. Все эти методы находят широкое применение в химико-фармацевтической промышленности.
Наиболее разнообразную группу реакций восстановления занимают химические методы.
Восстановление металлами
Восстановление натрием. Известны 3 метода восстановления натрием: восстановление амальгамой натрия, восстановление натрием со спиртом, восстановление растворами натрия в жидком аммиаке.
Восстановление амальгамой натрия. Высокая реакционная способность натрия не позволяет работать с ним в водной среде. Раствор натрия в ртути (амальгама) реагирует с водой значительно медленнее, что позволяет использовать амальгаму натрия в качестве восстановителя. Амальгама с массовой долей натрия менее 1,25% при комнатной температуре является жидкой, а при более высокой концентрации – твердой.
Растворение натрия в ртути ведут под слоем толуола или в атмосфере инертного газа (азота), чтобы предохранить теплую амальгаму от окисления воздухом. Растворение натрия в ртути - процесс экзотермический, обычно его проводят при 40–500С.
Наиболее чистую амальгаму получают электролитическим методом. В качестве катода применяют ртуть, а анода – платину, их помещают в раствор натриевой соли (NaCl, NaHCO3). Так получают чистую 0,5%-ую жидкую амальгаму.
Восстановление амальгамой ведут в водной или спиртовой среде. К раствору или суспензии органического вещества постепенно добавляют амальгаму с 25-40%-ным избытком. Конец процесса определяют по полному разложению амальгамы и выделению ртути. Ее отделяют декантацией и промывают водой или спиртом. Скорость восстановления выше в щелочной среде. Процесс восстановления идет по ионному механизму: сначала один или два электрона присоединяются к молекуле восстанавливаемого вещества в адсорбционном слое на поверхности металла. Затем образующиеся анионные радикалы соединяются с протонами:

Этиленовые изолированные связи не восстанавливаются амальгамой натрия, сопряженные же двойные связи легко восстанавливаются.
Легко восстанавливается амальгамой натрия карбонильная группа в альдегидах и кетонах до соответствующих спиртов. Гидроксильные группы на водород обычно не обмениваются. Карбоновые кислоты также устойчивы к действию амальгамы.
Нитро- и другие азотсодержащие группы легко восстанавливаются амальгамой натрия, но для этого можно использовать более дешевые восстановители.
В![]() спиртов:
спиртов:
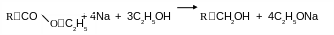
Восстановление ведут металлическим натрием в среде безводного спирта. Этим методом обычно получают высшие алифатические спирты, которые трудно получить иначе. У многоосновных кислот восстанавливаются только этерифицированные карбоксильные группы.
По этому методу к кипящей смеси сложного эфира и 5-кратного количества абсолютного спирта в колбе, снабженной мощным обратным холодильником, добавляют кусочки металлического натрия, взятого в небольшом избытке. После некоторой выдержки реакционную смесь выливают в воду для разложения алкоголятов. Спирт отгоняют, а продукты реакции экстрагируют. Так как реакция сильно экзотермическая, следует обеспечить хороший отвод тепла.
Выходы целевых продуктов не более 80%, так как образуются побочные продукты реакции.
Восстановление натрием в жидком аммиаке. Жидкий аммиак и низшие алифатические амины способны растворять щелочные металлы (Na, K, Li).
Этим методом можно восстанавливать гидролизующиеся в воде соединения.
Необходимо знать, что температура кипения раствора натрия и других металлов в аммиаке очень низка (минус 33,50С). Поэтому процесс ведут в герметичной специальной аппаратуре, а при повышенной температуре – в автоклаве. Для большой поверхности контакта необходимо сильное перемешивание.
Сложные эфиры так восстанавливаются быстрее и с большим выходом, чем по методу Буво-Блана.
Галогенпроизводные также легко реагируют:

Ацетилены восстанавливаются до олефинов только транс-конфигурации:

Моноалкилацетилены обычно не восстанавливаются.
Восстановление оловом и его солями – простой известный способ, который широко применяется в лабораторной практике. Он удобен для превращения ароматических нитросоединений в амины. В промышленности метод не применяется из-за дороговизны:
![]()
Восстановление идет ступенчато:
![]()
Образующийся хлорид олова (II) также может восстанавливать и даже сильнее и лучше, чем металлическое олово. Так как двухлористое олово растворимо в воде и спирте, реакции можно вести в гомогенной среде.
![]()
C помощью SnCl2 можно восстанавливать до аминов азосоединения
![]()
Хлорид олова (II) восстанавливает группу диазония до гидразогруппы.
![]()
Восстановление цинком проводят как в кислой, так и в щелочной среде. Восстановление цинком в кислой среде аналогично восстановлению оловом, однако ZnCl2 восстановительными свойствами не обладает. Промышленное значение получило восстановление цинком в щелочной среде. Цинк обычно используют в виде пыли с избытком 10-15%.
Ароматические соединения превращаются в гидразосоединения:
2RNO2 + 5Zn + 10NaOH → R-NH-NH-R + 5Na2ZnO2 + 4H20
Образующийся цинкат в условиях реакции гидролизуется, давая гидроокись цинка:
![]()
Так как NaОН в реакции не расходуется, его берут из расчета от 0,1 до 0,2 моля на 1 моль нитросоединения. Восстановление нитросоединений цинком в щелочной среде проводят в стальных и чугунных аппаратах с рубашкой и якорной мешалкой, так как образуется вязкая масса.
В присутствии кислот цинк восстанавливает хлорангидриды арилсульфокислот до тиофенолов.
![]()
Серьезная проблема при восстановлении оловом и цинком – это очистка производственных сточных вод.
Восстановление железом (чугунными стружками) ароматических нитросоединений до соответствующих аминов - один из распространенных промышленных способов. При восстановлении железом протекают такие реакции:
![]()
![]()
![]()
![]()
Скорость процесса восстановления лимитируется первой стадией, аналогичной процессу влажной коррозии железа. Для этого процесс ведут в среде электролита (NH4Cl, FeCl2, (NH4)2SO4, NaCl и других). Их вводят в реакционную массу в готовом виде или получают в реакторе при протравливании чугунной стружки соляной кислотой.
В промышленности восстановление проводят в футерованных диабазовой плиткой стальных или чугунных аппаратах (редукторах), снабженных мешалкой (лопастной или сошниковой) и барботером для подачи пара. Процесс ведут при температуре кипения реакционной массы. Смесь обогревают острым паром, который к тому же выводит образующийся амин (перегонка с водяным паром). Нитросоединения загружают порциями. Смесь паров амина и воды конденсируют и разделяют в отстойнике.
Амины, плохо перегоняющиеся с водяным паром, экстрагируют из реакционной массы органическими растворителями.
