
- •V. Физическая химия
- •1. Основные понятия термодинамики
- •1.1. Первое начало термодинамики
- •1.2. Применение первого начала термодинамики к гомогенным однокомпонентным закрытым системам
- •Зависимость теплового эффекта реакции от температуры. Закон Кирхгоффа
- •1.3. Второе начало термодинамики. Энтропия
- •Статистическая интерпретация энтропии
- •Расчет абсолютной энтропии
- •1.4. Термодинамические потенциалы
- •Условия самопроизвольного протекания процессов в закрытых системах
- •2.1. Диаграмма состояния воды
- •3. Свойства растворов
- •3.1. Термодинамика растворов
- •Растворимость газов в газах
- •3.2. Коллигативные свойства растворов неэлектролитов
- •Давление насыщенного пара разбавленных растворов
- •Давление пара идеальных и реальных растворов
- •Температура кристаллизации разбавленных растворов
- •Температура кипения разбавленных растворов
- •Осмотическое давление разбавленных растворов
- •3.3. Растворы электролитов
- •3.4. Коллигативные свойства растворов электролитов:
- •Теория электролитической диссоциации Аррениуса
- •Слабые электролиты. Константа диссоциации
- •4. Электропроводность растворов электролитов
- •5. Электрохимические процессы
- •5.1. Электродные потенциалы. Гальванические элементы. Эдс
- •Правила июпак для записи гальванических элементов и реакций, протекающих в них
- •5.2. Классификация электродов
- •Окислительно-восстановите льные электроды
- •6. Поверхностные явления и адсорбция
- •6.1. Поверхностное натяжение и адсорбция по Гиббсу
- •Классификация веществ по влиянию на поверхностное натяжение растворителя
- •6.2. Адсорбция на границе твердое тело – газ
- •6.3. Адсорбция из растворов электролитов
- •7. Коллоидные (дисперсные) системы
- •7.1. Классификация и способы получения дисперсных систем
- •Способы получения коллоидных систем Диспергирование
- •Конденсация
- •7.2. Оптические свойства дисперсных систем
- •7.3. Молекулярно-кинетические свойства
- •7.4. Строение мицеллы
- •7.5. Устойчивость и коагуляция
- •Виды коагуляции электролитами
- •Правила коагуляции
7.5. Устойчивость и коагуляция
Устойчивость дисперсных систем характеризует способность дисперсной фазы сохранять состояние равномерного распределения частиц во всем объеме дисперсионной среды.
Существует два вида относительной устойчивости дисперсных систем: седимента-ционная и агрегативная.
Седиментационная устойчивость – способность системы противостоять действию силы тяжести. Седиментация – это оседание частиц в растворе под действием силы тяжести.
Условие седиментационного равновесия: частица движется с постоянной скорость, т. е. равномерно, сила трения уравновешивает силу тяжести:
6πηrU = 4/3πr3(ρ – ρ 0)g,
где ρ – плотность дисперсной фазы, ρ0 – плотность дисперсионной среды, g – ускорение силы тяжести, η – вязкость среды.
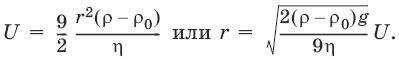
Агрегативная устойчивость характеризует способность частиц дисперсной фазы противодействовать их слипанию между собой и тем самым сохранять свои размеры.
При нарушении агрегативной устойчивости происходит коагуляция – процесс слипания частиц с образованием крупных агрегатов. В результате коагуляции система теряет свою седиментационную устойчивость, т. к. частицы становятся слишком крупными и не могут участвовать в броуновском движении.
Причины коагуляции:
> изменение температуры;
> действие электрического и электромагнитного полей;
> действие видимого света;
> облучение элементарными частицами;
> механическое воздействие;
> добавление электролита и др.
Наибольший практический интерес вызывает коагуляция электролитами.
Виды коагуляции электролитами
Концентрационная коагуляция наступает под действием индифферентных электролитов. Индифферентным называется электролит, при введении которого межфазный потенциал <р не изменяется. Данный электролит не содержит таких ионов, которые были бы способны к специфической адсорбции на частицах по правилу Па-нета-Фаянса, т. е. не способны достраивать кристаллическую решетку агрегата:

Состояние, при котором диффузный слой исчезнет и коллоидная частица становится электронейтральной, называется изоэлектрическим – электрокинетический потенциал (ζ) равен нулю, наступает коагуляция. Формула мицеллы в таком состоянии приобретает вид: m[AgI]nAg+nNO3¯0.
Нейтрализационная коагуляция происходит при добавлению к золю неиндифферентного электролита. Неиндифферентным называется электролит, способный изменить межфазный (φ) и линейно с ним связанный электрокинетический (ζ) потенциалы, т. е. данный электролит содержит ионы, способные специфически адсорбироваться на поверхности агрегата, достраивать его кристаллическую решетку или химически взаимодействовать с потенциалоп-ределяющими ионами.

Обратимый процесс, при котором коагулят вновь переходит в коллоидное состояние, называется пептизацией или дезагрегацией.
Правила коагуляции
1. Все сильные электролиты, добавленные к золю в достаточном количестве, вызывают его коагуляцию. Минимальная концентрация электролита, вызывающая коагуляцию золя за определенный короткий промежуток времени, называется порогом коагуляции:

где Сэл – концентрация электролита-коагулятора; V эл – объем добавленного электролита; V золя(обычно 10 мл) – объем золя.
2. Коагулирующим действием обладает тот ион, заряд которого совпадает по знаку с зарядом противоионов мицеллы лиофобного золя (заряд коагулирующего иона противоположен заряду коллоидной частицы). Этот ион называют ионом-коагулянтом.
3. Коагулирующая способность иона – коагулянта тем больше, чем больше заряд иона:
![]()
Правило значности:
γ1 : γ2 : γ3 = 1/16 : 1/26 : 1/36 = 729 : 11 : 1
Коагулирующая способность иона при одинаковом заряде тем больше, чем больше его кристаллический радиус. Ag+ > Cs+ > Rb+ > NH4+ > K+ > Na+ > Li+ – лиотропный ряд.
Коллоидной защитой называется повышение агрегативной устойчивости золя путем введения в него ВМС (высокомолекулярное соединение) или ПАВ (поверхностно-активного вещества).
Защитным числом называется минимальное количество миллиграммов сухого вещества, которое необходимо для защиты 10 мл золя при добавлении к нему электролита в количестве, равном порогу коагуляции.
