
- •6) Теплоемкость твердых тел.
- •2)Силы взаимодействия в твердом теле. Силы Ван-дер-Вальса
- •3) Анизотропия
- •10) Зонная теория тв тел приближение сильной связи
- •4) Квантовым осциллятором
- •12) Движение элек в переодич поле кристал реш.
- •5) Классическая Теория теплоемкости Дилонга-Пти.
- •8) Зонная теория твердого тела.
- •7) Квантовая теория свободных электронов в металле.
- •11) Полупроводники
- •9)Распределение Ферми-Дирака, Бозе-Эйнштейна, Максвела, Ферми-Дирак
- •14) Удельная электропровод.
- •15) Удел. Электропровод полупроводников
- •16) Зависимость электропровод собствен и не вырожден полупровод от ширины зз
- •17) Примесные полупроводники.
- •18) Терморезистор
- •19) Эффект Холла.
- •20) Получение p – n перехода
- •21) Электрическое поле барьера при равновесном сост-ии p-n перехода.
- •23) Обратное подключение p-n перехода. Вах
1) Кристаллические решётки веществ упорядоченное расположение частиц в строго определённых точках пространства. Точки размещения частиц называют узлами кристаллической решётки. Типы кристаллических решеток:
Ионными называют кристаллические решетки, в узлах которых находятся ионы. Их образуют вещества с ионной связью. Ионные кристаллические решётки имеют соли, некоторые оксиды и гидроксиды металлов.

Существует 3 основных типа таких структур: гексагональная плотная упаковка, гранецентрированная кубическая упаковка и объемно центрированная кубическая упаковка. Эти решетки называются решетками Бравэ.

В выбранной системе координат удобно в качестве трех опорных точек взять точки пересечения заданной плоскости с осями координат. Пусть определяемая узловая плоскость S пересекает оси координат в точках А, В, С и отсекает по осям отрезки х = 1, y = 2, z = 3.
Далее поступают по следующей схеме;
1) берут отрезки, отсекаемые плоскостью на осях координат: 1:2:3;
2)
берут величины, обратные этим отрезкам: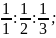
3)
приводят к общему знаменателю: ;
;
4) отбрасывают знаменатель: 6:3:2 – индексы Миллера для плоскости.
6) Теплоемкость твердых тел.
Температура Дебая — температура, ниже которой молярная теплоемкость изменяется, выше которой теплоемкость не изменяется С=3R.

Теплоемкость твердого тела должна существенно уменьшаться при понижении температуры кристалла ниже его характеристической (дебаевской) температуры.
Температура Дебая была получена из квантовомеханических представлений.
Температура
Дебая определяется следующей формулой:
где h —
постоянная Планка,  —
максимальная частота колебаний атомов
твёрдого тела, k —постоянная
Больцмана.
—
максимальная частота колебаний атомов
твёрдого тела, k —постоянная
Больцмана.
2)Силы взаимодействия в твердом теле. Силы Ван-дер-Вальса
Основу ван-дер-вальсовых сил составляют кулоновские силы взаимодействия между электронами и ядрами одной молекулы и ядрами и электронами другой. На определенном расстоянии между молекулами силы притяжения и отталкивания уравновешивают друг друга, и образуется устойчивая система. Энергия ван-дер-ваальсовской связи низка, все структуры, ею обусловленные, мало устойчивы, имеют низкие точки плавления. Ориентационное взаимодействие. Взаимодействие между полярными молекулами, т. е. молекулами с постоянными дипольными моментами. При низких температурах дипольные моменты молекул ориентируются.
Силы взаимодействия между двумя диполями можно вычислить с помощью закона Кулона. Эти силы зависят от ориентации диполей, поэтому они ориентационные.

Для взаимодействия двух диполей энергия притяжения между ними (энергия Кеезома).
Притяжение диполь-диполь может осуществляться только тогда, когда энергия притяжения превышает тепловую энергию молекул; обычно это имеет место в твердых и жидких веществах. Диполь-дипольное взаимодействие проявляется в полярных жидкостях (вода, фтороводород).
Индукционное взаимодействие
Проявляется у полярных молекул и может возникать наведенный электрический момент под действием соседних молекул. Этот вид сил проявляется у молекул характеризующихся высокой поляризуемостью.(свойство вещества приобретать электрич. или дипольный момент).

Энергия притяжения между постоянным и наведенным диполем (энергия Дебая).
Притяжение постоянного и наведенного диполей обычно очень слабое, поскольку поляризуемость молекул большинства веществ невелика. Оно действует только на очень малых расстояниях между диполями. Этот вид взаимодействия проявляется главным образом в растворах полярных соединений в неполярных растворителях.
Дисперсионное взаимодействие
Возникает между молекулами с насыщенной химической связью (О2,Н2,N2). Эти молекулы не обладают дипольным моментом. При сближении атомов устанавливается кореляция (согласование) мгновенных дипольных моментов соседних атомов, что приводит к возникновению сил взаимодействия. Природа этих сил электростатическая.
Эти связи очень слабые - самые слабые из всех межмолекулярных взаимодействий. Однако они являются наиболее универсальными, так как возникают между любыми молекулами.
Ионная связь обусловлена тем, что образуя химическую связь атом отдает свои валентные электроны или принимает. Затем эти электроны взаимодействуют по закону Кулона.
Ковалентная связь возникает между однородными атомами. Ковалентная связь возникает за счет обмена двух атомов. Общая электронная оболочка связывает между собой ионы.
