
Одержання, очистка та властивості колоїдних розчинів
Розчини – це гомогенні системи, що складаються з розчинника та розчиненої речовини.
Дисперсна фаза – це розчинена речовина.
Дисперсійне середовище – це розчинник.
Ступінь дисперсності – це ступінь подрібненості розчиненої речовини.
Класифікація розчинів за ступенем подрібненості:
1) істинні розчини – розміри розчинених частинок менше 1 нм;
2) колоїдні розчини – розміри частинок 1 – 100 нм;
3) грубодисперсні розчини (зависі) – частинок більше 100 нм:
емульсії (рідка фаза) – креми, мазі, молоко;
суспензії (тверда фаза) – зависі мулу або крейди у воді
аерозолі.
Золі – це колоїдні розчини, в яких колоїдні частинки знаходяться в рідкому середовищі.
Будова міцели (колоїдної частинки):
Міцела – елементарна колоїдна частинка, яка містить нерозчинне в даному дисперсійному середовищі ядро.
Будова міцели AgI в розчині КІ
AgNO3 + KI → AgI + KNO3

Будову даної міцели можна представити формулою:
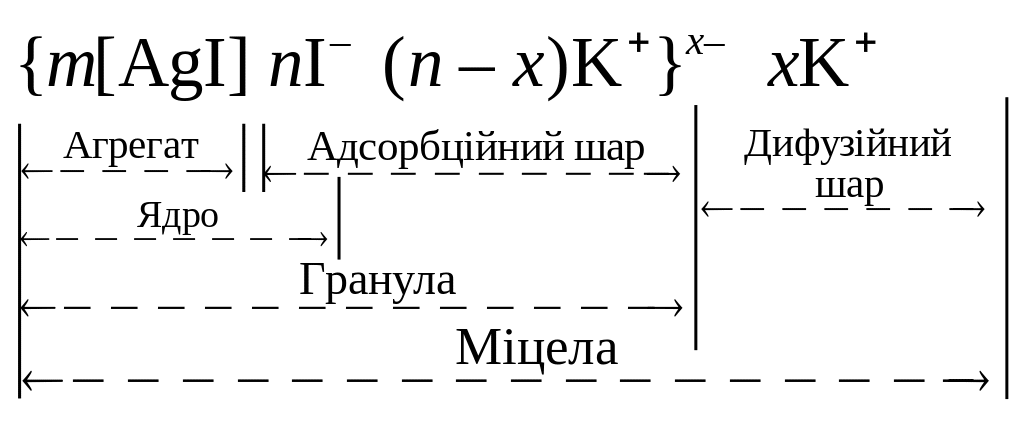
Методи отримання колоїдних розчинів:
Дисперсійні методи (методи подрібнення твердих тіл до частинок колоїдного розміру):
механічне подрібнення (розтирання та подрібнення в спеціальних млинах);
метод електричного розпилення (пропускають струм між електродами, зануреними у воду. Електроди виготовлені з того матеріалу, з якого готують колоїдний розчин: Pt, Au, Ag та інші);
метод з використанням ультразвуку.
Методи конденсації (агрегація частинок у більш крупні частинки:
заміна розчинника
Наприклад, золь прополісу: 30г прополісу + 100г спирту 96% (розчиняється),
збовтують на протязі тижня, а потім фільтрують і
додають воду (не розчиняється) → молекули
переходять в колоїдні частинки.
Використання: пити або полоскати при хронічних захворюваннях.
конденсація з пари крізь холодну воду, що містить стабілізатор можна отримати золь Hg, S, Se);
хімічна конденсація (методи засновані на хімічній реакції між речовинами, яка призводить до утворення нерозчинної або малорозчинної речовини).
Наприклад, отримання червоного золю Au:
а) відновлення Au з його солі формальдегідом
2NaAuO2 + 3HCOH + Na2CO3 → 2Au + 3HCOONa + NaHCO3 + H2O
б) утворення колоїдних частинок



 або
[Au]m
·
nAuO2–
·
(n–x)Na+
x–
xNa+
або
[Au]m
·
nAuO2–
·
(n–x)Na+
x–
xNa+
Методи очищення колоїдних розчинів
Мета очищення: зменшення числа непотрібних іонів та молекул, що адсорбовані на поверхні колоїдних частинок, з метою підвищення стійкості колоїдних розчинів.
Діаліз – це метод, заснований на властивостях напівпроникливої мембрани пропускати домішки іонів та молекул малих розмірів та затримувати колоїдні частинки. Процес проводять в апараті – діалізаторі:

схема діалізатора
(потребує багато часу і недостатньо ефективний)
с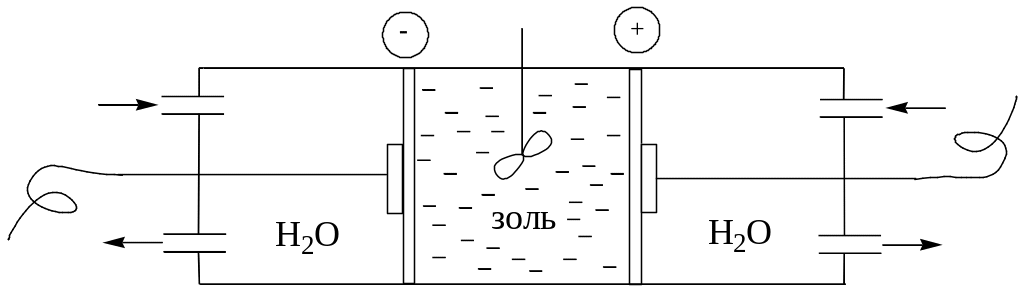 хема
електродіалізатора
хема
електродіалізатора
(не потребує багато часу, ефективна
Ступінь очищення)
Ультрафільтрація – процес фільтрування колоїдних розчинів крізь напівпроникливі мембрани (колоїдні розчини залишаються на фільтрі, а фільтрат з розчиненими електролітами проходить крізь фільтр).
Властивості колоїдних розчинів
Молекулярно-кінетичні властивості:
Броунівський рух.
Осмотичний тиск (набагато менший, ніж для істинних розчинів, тому що розмір частинок більший → кількість менша → концентрація менша)
ν
π = ––––
RT
Na
ν – часткова концентрація (число частинок в одиниці об’єму)
Дифузія – це повільний процес вирівнювання концентрації частинок по всьому об’єму розчину під впливом теплового (броунівського) руху.
Седиментація – це процес зсідання колоїдних частинок в розчині або в газоподібному середовищі під дією сили тяжіння (або вспливання, наприклад, краплі в емульсії – зворотна седиментація).
