
Дист лекции Кудряшов / Хим равновесие - 2
.pdf
ХИ М И Ч Е С К О Е Р А В Н О В Е С И Е В
ГЕ Т Е Р О Г Е Н Н Ы Х С И С Т Е М А Х
Рассмотрим самопроизвольно протекающую реакцию при постоянстве P и
T:
aAтв.+bBг. cCж.+dD г.
Будем считать, что участвующие в ней вещества являются B и D идеальными газами и находятся в таких количествах, что убыль реагентов и образование продуктов реакции в смеси по стехиометрии не приводят к изменению состава и условий существования системы. Это означает, что если в исходной смеси идеальных газов парциальные давления были то после одного пробега реакции, т.е. после превращения стехиометрических
количеств веществ эти давления практически не изменятся. Будем также считать, что вещества A и C находятся в конденсированном состоянии
(например, A в твердом, а C в жидком) и в этом состоянии не образуют растворов (твердых или жидких). Тогда их химические потенциалы будут постоянны и равны мольным изобарным потенциалам при рассматриваемых условиях.
Изменение энергии Гиббса данной реакции равно разности между энергией Гиббса продуктов и исходных веществ.
∆ G P,T = Gпрод. – Gисх. = с GС + d GD - a GA - b GB,
где Gi – мольные энергии Гиббса, соответствующих компонентов или их химические потенциалы.
Для идеальных газов:
i
|
0 |
(T ) RT ln |
|
i |
|||
|
|
~ Рi
, где
~ |
|
P |
|
P |
|
P |
|
i |
i |
||
i |
|
P |
0 |
|
1атм |
|
|
|
|||
|
|
|
|
||
|
|
i |
|
|
|
Pi
(атм.),
Тогда:
|
|
0 |
~ |
0 |
|
|
|
~ |
a A |
|
|
∆ G P,T = d D |
RT ln PD |
c C b B |
RT ln PB |
||||||
Раскрывая скобки, получим уравнение: |
|
|
|
|
|
|
||||
|
|
|
|
|
|
~ d |
|
|
|
|
|
|
∆ G P,T = |
|
P |
|
|
|
|||
|
|
r GT RT ln |
|
~ b |
|
, |
|
|||
|
|
|
|
|
|
P |
|
|
|
|
|
|
|
|
|
B |
тек . |
|
|
||
где r GT |
d D |
b B - a A b B , а индекс «тек.» |
указывает на то, что |
|||||||
|
0 |
0 |
|
|
|
|
|
|
|
|
берутся текущие парциальные давления в рассматриваемой газовой смеси.
А |
При равновесии ∆ G P,T =0. Если внешнее давление равно 1 атм., то |
||||||||
А , |
С |
С |
, а r GT |
d D |
b B |
- a A |
b B |
. |
|
|
0 |
|
0 |
|
0 |
0 |
0 |
0 |
|
Тогда термодинамическая константа равновесия будет равна:
|
|
~ d |
|
|
P |
||
|
D |
|
|
K p |
~ b |
||
|
|
P |
|
|
B |
||
|
|
G |
|
||
|
|
|
|
|
|
|
|
r |
T |
|
|
e |
RT |
, |
|||
|
|||||
|
|
|
|||
равн ..
т.е. давления, соответствующие чистым конденсированным фазам, из формулы для K p выпадают, учитываются только те вещества, которые
присутствуют в газообразных состояниях.
Наиболее просто
K p
выражается для реакции, включающей одно
газообразное вещество, когда она совпадает с давлением этого вещества. Это давление называется давлением диссоциации. Например:
СаCO3 CaO+CO2 MgCO3 MgO+CO2
K K
p1 |
=(pCO2)1 |
|
|
p 2 |
=(pCO2)2. |
|
|
Следует отметить, что
K p1
≠
K p 2
(Давления диссоциации разные).
Температура, при которой давление диссоциации равно атмосферному (внешнему) и, следовательно, равновесие становится невозможным, называется температурой разложения.
Если реакция идет между несмешанными конденсированными фазами, то химическое равновесие невозможно, а следовательно говорить о константе равновесия бессмысленно. Реакция будет идти до полного израсходования одного из реагентов или всех, если они взяты в стехиометрических количествах. Примером может служить реакция магниетермического получения кремния:
SiO2,тв. + 2Mgтв. =Siтв. + 2MgOтв.
Поскольку участники реакции не образуют растворов, то для
P,T зависит только температуры и внешнего давления и не зависит от количеств реагирующих веществ в системе. (Концентрации исходных веществ не уменьшаются, а продуктов не увеличиваются). В принципе может существовать такая пограничная температура, при которой реакция не протекает ни в прямом , ни в обратном направлении. В этом случае система будет находиться в безразличном направлении. При этой температуре ∆ G P,T=0. При повышении температуре ∆ G P,T может стать меньше нуля и реакция тогда пойдет в прямом направлении до конца, тогда при понижении температуры ∆ G P,T станет больше нуля и реакция пойдет в обратном направлении.
Зависимость константы химического равновесия от температуры, вывод уравнения изобары Вант-Гоффа
Температурная зависимость термодинамической константы равновесия передается уравнением изобары Вант-Гоффа.
Для вывода этого уравнения запишем дифференциальное уравнение Гиббса-Гельмгольца для химической реакции.
|
|
|
|
G 0 |
|
|
r G p0,T |
r H p0,T |
T |
r |
|
|
|
T |
||||||
|
|
|
|
|||
|
|
|
|
|
P |
|
Подставляя в это уравнение выражение для стандартного изменения энергии Гиббса из уравнения изотермы Вант-Гоффа для условий равновесия:

|
G |
0 |
RT ln K |
0 |
|
P ,T |
p |
||||
r |
|
|
и производную от этого стандартного изменения:
G |
0 |
|
|
|
ln K |
0 |
|
|
||
|
|
|
|
|
|
|
|
|
||
|
|
|
R ln K |
|
RT |
|
|
|
|
|
r |
|
0 |
|
p |
|
|||||
|
|
|
|
|
|
|
|
|||
T |
|
|
p |
T |
|
|
||||
|
|
P |
|
|
|
|
|
|||
|
|
|
|
P |
||||||
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
получим уравнение изобары Вант-Гоффа:
RT ln
K |
0 |
|
p |
||
|
=
H |
0 |
|
|
|
r |
|
p ,T |
|
|
|
d ln K |
|||
|
||||
|
|
|
dT |
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
RT ln K |
0 RT 2 |
ln K p |
|
|||||
|
||||||||
|
|
|
p |
|
|
|
T |
|
|
|
|
|
|
|
|
P |
|
0 |
|
H |
0 |
|
|
|||
|
|
|
||||||
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
p |
|
r |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
RT |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Вывод уравнения изохоры Вант – Гоффа
Прологарифмируем уравнение связи между Kp и Kc: Kp = Kc(RT)Δν и возьмем производную по T:
d ln K |
P |
|
d ln K |
C |
|
d ln T |
. |
|
|
|
|||||
dT |
|
dT |
|
dT |
|||
|
|
|
|
|
Заменив левую часть в этом выражении Гоффа, получим:
H |
|
d ln K |
C |
|
|
r |
|
|
|||
|
|
|
|
||
RT |
2 |
|
dT |
|
|
|
|
|
|
||
на
T
правую в изобаре Вант-
,
и выразив тепловой эффект при постоянном давлении через тепловой эффект при постоянном объеме, получим уравнение изохоры Вант – Гоффа:
d ln K |
C |
|
U |
|
|
r |
|
||
|
|
|
||
dT |
|
|
RT |
2 |
|
|
|
||
Анализ уравнения изобары Вант-Гоффа.
Для анализа влияния температуры на величину константы равновесия необходимо определить знак производной. Он определяется знаком теплового эффекта химической реакции: для экзотермических реакций, у
которых |
r |
p ,T |
<0, повышение температуры приводит к уменьшению |
|
|
H |
|
|
|
0 |
|
константы равновесия, для эндотермических реакций, у которых
H |
|
|
0 |
r |
p ,T |
>0,
повышение температуры приводит к росту константы равновесия. Если тепловой эффект реакции равен нулю, то константа равновесия не зависит от температуры.
Графики температурной зависимости константы равновесия для экзотермической и эндотермической реакций представляют собой монотонно убывающую и возрастающую функции температуры соответственно:
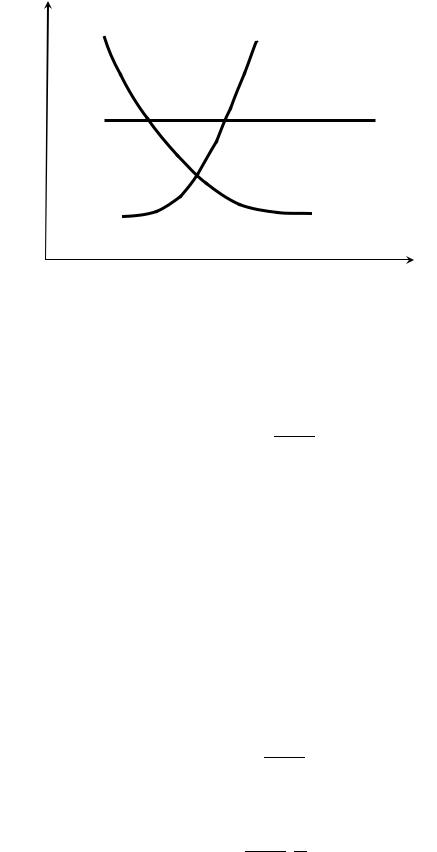
Kp
rH>0
rH=0
rH<0
T
Интегрирование уравнения изобары Вант-Гоффа.
Для того чтобы проинтегрировать уравнение изобары необходимо разделить в нем переменные, т.е. привести к виду:
|
|
|
H |
0 |
||
|
|
|
|
|
||
d ln K |
0 |
|
r |
|
dT |
|
p |
RT |
2 |
||||
|
|
|
||||
|
|
|
|
|
||
(1)
и взять интеграл. Интегрирование можно провести определенно и неопределённо.
Рассмотрим оба способа. Прежде чем их рассматривать, следует напомнить, то в физической химии различают истинный и средний тепловые эффекты химической реакции:
Средний тепловой эффект это тепловой эффект, который в некотором температурном интервале считается независимым от температуры.
=соnst ≠ f(T).
Истинный тепловой эффект это тепловой эффект химической реакции при данной температуре.
Проинтегрируем уравнение (1) неопределённо, считая, что r H 0 =соnst
≠ f(T).
d ln K |
0 |
|
p |
||
|
|
H |
0 |
|
|
|
|
|
|
r |
|
dT С |
RT |
2 |
||
|
|
|
|
Так как r H p0,T /R можно вынести за знак
ln K |
|
|
H |
0 |
1 |
С |
|
|
|
||||
0 |
r |
|
|
|||
|
p |
|
R |
|
T |
|
|
|
|
|
|
интеграла, то получим:
.
В координатах ln K p0 - 1/T график этой зависимости будет прямой линией с тангенсом угла наклона с положительной осью абсцисс равным
|
r H 0 |
( tg |
r H 0 |
): |
|
R |
R |
||||
|
|
|
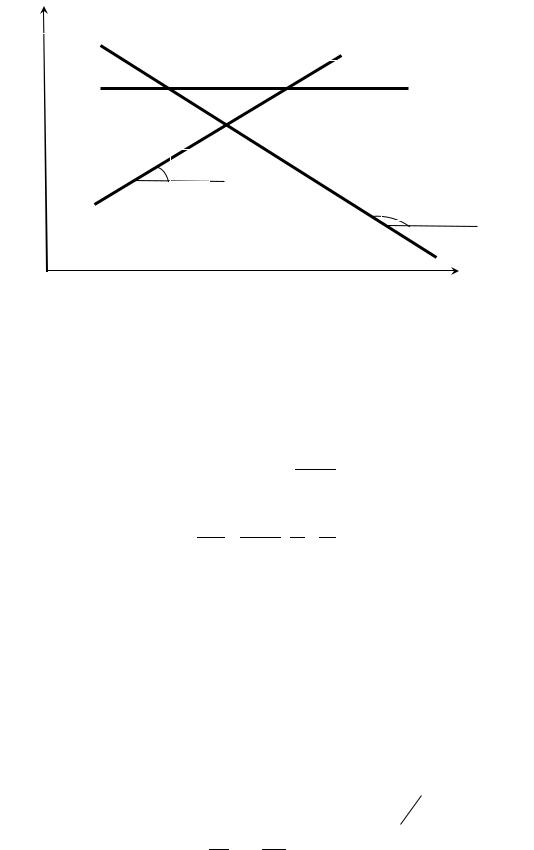
lnKp
rH<0
rH=0
α rH>0
α
1/T
Если имеется эмпирическое уравнение |
|
|
p |
|
||||||
|
|
|
|
|
|
|
|
ln K |
0 |
A B / T |
r |
|
|
BR , r S |
|
|
r G |
|
|
||
H |
0 |
0 |
AR , |
0 |
BR ART . |
|||||
|
|
|
|
|
|
|
|
|||
, то:
Если имеется эмпирическое уравнение
lg K |
0 |
|
p |
||
|
A' B' / T
, то:
0 |
2,3BR , |
0 |
2,3AR , |
0 |
2,3(BR |
r H p ,T |
r S p ,T |
r G p ,T |
Если проинтегрировать выражение
|
K |
p |
|
|
|
2 |
H |
0 |
||
|
|
2 |
0 |
|
T |
r |
|
|
||
|
|
1 |
d ln K p |
|
RT |
2 |
dT |
|||
K |
|
|
T |
|
|
|||||
p |
|
|
|
|
|
|||||
|
|
|
|
|
1 |
|
|
|
||
определенно, то получим:
ART )
.
K ln K
0 |
|
p |
2 |
0 |
|
p |
|
|
1 |
|
H |
0 |
|
1 |
|
|
|
|
|
|
r |
|
|
|
|
R |
|
|
T |
|
|
|
||
|
|
|
1 |
|
1 |
|
T |
||
|
||
|
2 |
.
Зная две константы при двух разных температурах, можно из этого уравнения рассчитать тепловой эффект этой реакции r H 0 , а также
константу равновесия при любой третьей температуре, находящейся в интервале температур, где соблюдается условие независимости теплового эффекта от температуры.
Для точного интегрирования уравнения изобары Вант-Гоффа необходимо знать зависимость теплового эффекта химической реакции от температуры. Эту зависимость можно получить из закона Кирхгоффа:
r HT
r HT0
c |
P |
r |
H |
0 |
|
dT const , |
||
aT |
b |
|
2 |
||
|
||
где
T |
2 |
|
|
|
с
c T
P
,
a bT
|
c |
2 |
|
T |
|||
|
|||
|
|
, const H 0
Константу интегрирования r H 0 можно найти, зная тепловой эффект
химической реакции при какой-либо температуре, например при 298K ( r H 298 ). Подставляя эту зависимость в изобару Вант-Гоффа, можно после ее
деления на RT2, выражения, можно
ln K P
разделения переменных и интегррования полученног получить следующее выражение:
|
|
|
|
d ln K P |
|
|
H |
|
|
|
|||||
|
|
|
|
r |
|
2 dT |
|
|
|
||||||
|
|
|
|
RT |
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
H |
0 |
|
a |
ln T |
b |
T |
|
c |
|
I , |
K P(298K ) I |
|||
|
|
|
|
|
|
|
|||||||||
RT |
R |
2R |
2RT |
2 |
|||||||||||
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
||||||||
Константу интегрирования I в этом уравнении также можно определить, зная K p при какой-либо температуре, например при 298K.
Если имеется эмпирическое уравнение зависимости |
K p |
|
0 |
аналитически и графически можно определить истинный химической реакции при необходимой температуре. эмпирическое уравнение имеет вид:
от температуры,
тепловой эффект Например, если
а
Kp
ln K |
P |
A B / T C ln T DT ET |
|
|
|
|
d ln K |
P |
|
|
B |
|
C |
D |
2E |
, |
|
||||||||
|
|
|
|
|
|
|
2 |
|
|
|
3 |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
dT |
|
|
|
T |
|
|
T |
|
|
|
|
|
T |
|
|
|
||
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
RT |
2 |
d ln K p |
|
RT |
2 |
|
B |
|
C |
|
||||||||
ист |
|
|
|
dT |
|
|
|
|
T |
2 |
T |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
rH>0
2
D
, то
|
2E |
|||
T |
3 |
|
||
|
||||
|
|
|
||
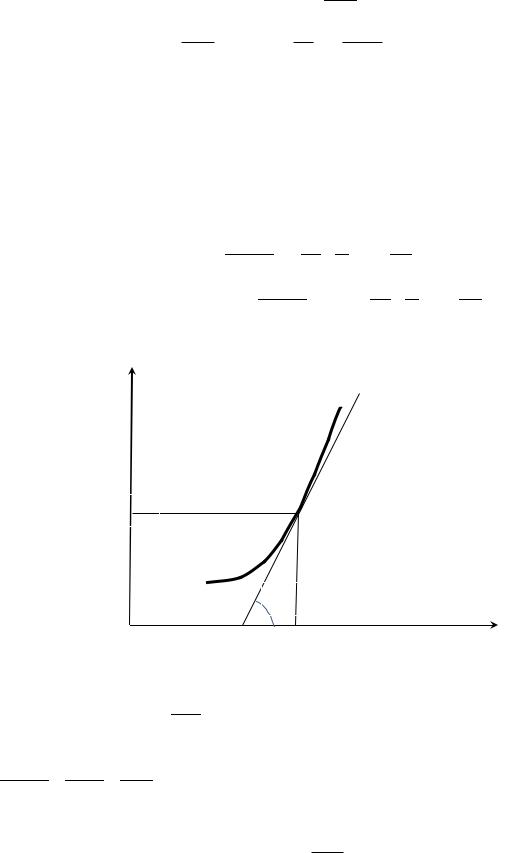
KpT1
α
T1 |
T |
На данном графике
dK |
p |
|
dT |
tg |
|
|
||
. Изобару Вант-Гоффа можно представить в
несколько иной форме, взяв производную сложной функции:
d ln K |
p |
|
|
dT |
|
|
dK |
p |
|
|
|||
K dT |
|||
|
|||
|
H |
|
r |
|
|
|
|
|
|
RT |
2 |
|
|
|
, отсюда следует: |
dK p |
|
r H |
K p |
и, наконец, получаем |
|
dT |
RT |
2 |
||||
|
|
|
|
|
||
основную формулу:
H ист RT12 tg K1
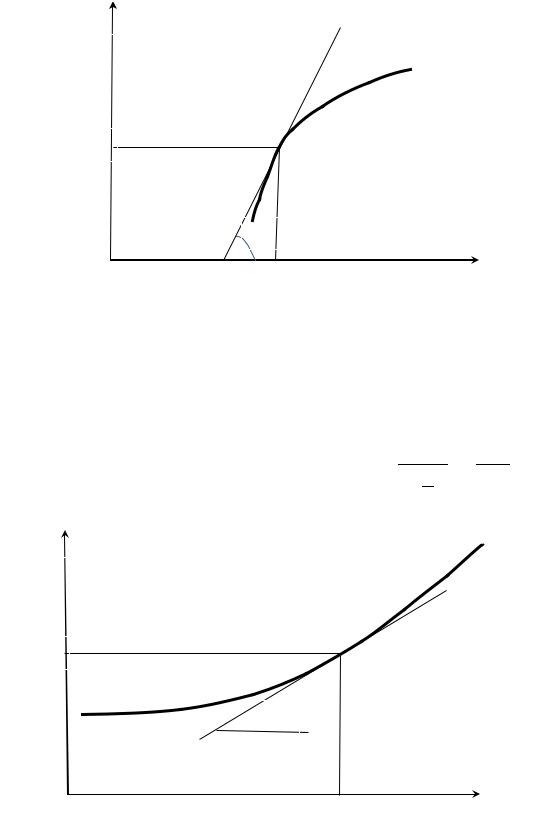
Если имеется график зависимости |
ln |
графически истинный тепловой химической температуре можно найти по другой формуле.
d ln K p0 |
d ln K |
|
2 |
|
|
|
tg , то H ист RT 2 |
|
RT |
|
tg . |
|
dT |
|
|||
dT |
|
|
|
||
lnKp
rH>0
lnKpT1
α
T1
K p |
от температуры, то |
0 |
|
реакции при необходимой Так как на данном графике
T
Если имеется график зависимости
ln K |
0 |
|
p |
||
|
от обратной температуры, и
тепловой |
химической реакции будет зависеть от |
температуры, то |
графически |
истинный тепловой химической реакции |
при необходимой |
температуре можно найти, преобразовав изобару Вант-Гоффа по следующей
формуле: H ист |
Rtg . |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
( |
d ln K p |
|
r H |
; |
d ln K p |
|
r H |
; |
d ln K p |
|
r H |
; |
d ln K p |
|
r H ) |
||||||
dT |
2 |
1 |
|
|
1 |
|
|
1 |
|
||||||||||||
|
|
RT |
|
|
R |
|
R |
|
R |
||||||||||||
|
|
|
|
|
|
|
|
dT |
|
|
|
d |
|
|
|
|
|
d |
|
|
|
|
|
|
|
|
T |
2 |
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
T |
|
|
|
|
T |
|
|
|
|||
lnKp
rH<0
lnKpT1

 α
α
1/T1 |
1/T |

Методы расчета констант химического равновесия
Вид выражения константы равновесия и ее числовое значение зависят от формы записи реакции, поэтому запись числового значения константы равновесия должна сопровождаться записью соответствующего уравнения реакции или полной записью выражения константы равновесия.
1. Расчет констант равновесия по данным о составе равновесной реакционной смеси.
Расчет эмпирических констант равновесия может быть осуществлен по закону действующих масс, если имеются данные о составе равновесной реакционной смеси (равновесные парциальные давления или равновесные концентрации компонентов реакции). Если имеется реакция
aA+bB cC+dD,
и известны парциальные давления, концентрации, мольные доли или данные о числе молей в равновесной смеси то:
|
P |
d |
P |
c |
|
|
|
|
|
||
K Р |
|
D |
C |
||
P |
a |
P |
b |
||
|
|
|
|
||
|
A |
B |
|||
, K С
равн.
с
с
d D a A
с с
c C b B
равн.
По формулам пересчета можно вычислить термодинамическую
константу равновесия |
|
0 |
K |
p . |
|
|
|
виде
2. Расчет констант равновесия с помощью изобары Вант-Гоффа в
|
G |
0 |
RT ln K |
0 |
|
p |
|||
r |
|
|
|
а) Если T 298 K
1)на основе стандартных значений f Gi0,298 ,
2)на основе термохимических данных,
0 |
r H |
0 |
298 r S |
0 |
, |
r G298 |
298 |
298 |
|
|
|
|
б) Если |
T 298 K |
r GT |
r |
HT |
T r ST : |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
1) по уравнению |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
0 |
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
T |
c |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
0 |
r H |
0 |
|
cP dT , |
r |
|
|
0 |
|
|
0 |
|
|
|
|
P |
dT |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
r H T |
298 |
ST S 298 |
T |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
298 |
|
|
|
|
|
|
|
|
|
|
298 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
с |
|
a bT cT |
2 |
|
c |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
P |
|
|
T |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
G 0 |
|
|
H 0 T |
S |
0 |
|
a(T 298) |
b |
(T 2 |
298 2 ) |
c |
(T 3 298 3 ) c ( |
1 |
|
1 |
) |
|||||||||||||||||||||||||||
r |
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||
r |
|
T |
|
298 |
|
r |
|
298 |
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
T |
|
|
298 |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
T |
|
a ln |
|
|
T |
|
b(T 298) |
|
c |
(T |
2 |
|
298 |
2 |
) |
c |
( |
1 |
|
1 |
|
) |
|
. |
|
|
||||||||||||
|
|
|
|
|
|
|
298 |
2 |
|
|
|
2 |
T |
2 |
298 |
2 |
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
,
В этих методах сначала рассчитывается энергия Гиббса реакции при необходимой температуре с использованием справочных таблиц.r H 2980 тепловой эффект реакции при 298 К; r S2980 – энтропия реакции при 298 К; ∆a , ∆b , ∆c , ∆c ′ – изменение коэффициентов температурной зависимости теплоемкости в ходе реакции.
Эту формулу можно преобразовать и рассчитывать энергию Гиббса реакции по методу Темкина-Шварцмана к виду:
где
|
|
G |
0 |
|
|||
|
|
|
|
|
|
|
|
|
|
r |
|
|
T |
|
|
M |
, M |
, M |
2 |
, M |
2 |
||
0 |
1 |
|
|
|
|
||
|
H |
0 |
T S |
0 |
T aM |
|
bM |
|
cM |
|
|
|
|
|
|
|
|
|
|
||
r |
|
298 |
r |
298 |
|
0 |
|
1 |
|
2 |
коэффициенты, полученные
c M 2
при
,
вычислении
интегралов, которые зависят только от температуры и которые затабулированы в справочниках с шагом 1000С.
Затем по уравнению изотермы Вант-Гоффа определяется константа равновесия:
|
|
|
|
G |
|
||
|
|
|
|
|
|
|
|
|
|
e |
|
r |
T |
|
|
K |
R T |
, |
|||||
|
|||||||
|
|
|
|
||||
|
p |
|
|
|
|
|
|
3. Расчет констант равновесия квантово-статистическим методом
Для газофазных реакций применяется метод, в котором используются
справочные
G |
0 |
H |
0 |
|
|
Ф’=- |
T |
|
298 |
|
|
|
|||
|
|
T |
|
|
298 К : |
f |
H |
0 |
|
0 |
||||
данные о приведенных энергиях Гиббса Ф=- |
G 0 |
H 0 |
или |
T |
0 |
||
|
T |
||
|
|
|
и стандартных теплотах образования веществ при 0 К или
или f |
H |
0 |
298 . |
Эти термодинамические функции связаны с константой равновесия следующими уравнениями:
|
|
|
|
1 |
|
G |
0 |
H |
0 |
|
|
||
ln K |
|
|
|
|
|
|
T |
|
|
0 |
|
||
|
|
|
|
|
|
r |
|
|
|
|
|||
|
P |
|
|
R |
|
T |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
1 |
|
|
0 |
H |
0 |
|
|
|
||
ln K P |
|
|
r |
GT |
298 |
|
|
||||||
|
|
|
|
|
T |
|
|
|
|||||
|
|
|
R |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
H |
r |
|
T |
|
r H
T
0 |
|
, |
0 |
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
298 |
. |
|
|
|
|
|
|
|
Значения приведенной энергии Гиббса представлены в справочниках в широком интервале температур с шагом в 1000С. Величины приведенных энергий Гиббса довольно слабо зависят от температуры, и если требуемое значение температуры не совпадает с приводимыми в таблице, то нужное значение можно найти с помощью линейной интерполяции.
4. Расчет констант равновесия по температурным зависимостям
В этом методе используются равновесия, приведенные в справочнике для ряда газофазных реакций, вида:
lg K |
0 |
|
P |
||
|
|
A |
B lg T CT F .... |
|
T |
|||
|
|
Для расчета константы равновесия достаточно подставить указанную температуру в соответствующее уравнение. Переведя эту зависимость десятичного логарифма константы равновесия от температуры в зависимость натурального (умножив правую и левую часть на 2,3, как это было сделано чуть выше), взяв производную и умножив левую и правую часть, полученного равенства на RT2 можно

получить величину теплового эффекта химической реакции при требуемой температуре
5. Метод комбинирования химических уравнений
Метод используется в тех случаях, когда путем алгебраического сложения уравнений для ряда реакций, константы равновесия которых известны, может быть получено уравнение искомой химической реакции. Тогда алгебраическая сумма энергий Гиббса этих реакций
будет равна энергии Гиббса искомой реакции: r Gi |
r Gиск |
Например, необходимо определить K 3 , зная K 1 и K 2.
1)FeO Fe 0,5О |
|
|
|
|
|
|
|
G |
0 |
, K |
|
|
|
|||||||||||||||
2 |
|
|
|
|
|
|
|
1 |
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|||
2) 2H |
О 2H |
|
|
О |
|
|
|
|
|
|
|
|
G |
0 |
, K |
|
||||||||||||
2 |
|
2 |
|
|
|
|
|
r |
2 |
|
2 |
|||||||||||||||||
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
3)FeO H |
|
Fe H |
O |
|
G |
0 |
, K |
|
|
|||||||||||||||||||
2 |
|
x |
3 |
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|||||
G |
0 |
|
1 |
G |
0 |
G |
0 |
, |
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
x |
|
|
2 |
|
r |
|
2 |
|
|
|
|
r |
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
RT ln K |
0 |
1 2 RT ln K |
0 |
|
|
RT ln K |
|
0 |
|
|
|
|||||||||||||||||
p , x |
p ,2 |
|
|
p / 1 |
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Сокращая на RT и потенциируя полученное выражение, получим: |
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
K |
|
|
|
K |
|
|
|
K |
1 / 2 |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
p , x |
|
p ,2 |
|
|
|
p ,1 |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
6. Расчет по величинам логарифмов констант равновесия реакций образования соединений из простых веществ
Расчет константы равновесия реакции при заданной температуре
проводится на основании справочных данных по уравнению: |
|
lg K a,T i lg K f ,i |
i lg K f ,i |
прод |
исх |
где |
K f ,i |
компонента.
– константа равновесия реакции образования i-го
Влияние различных факторов на сдвиг химического равновесия.
Направление сдвига химического равновесия можно легко определить с помощью принципа, сформулированного Ле Шателье в конце 19-ого века для химического равновесия. Как потом было доказано философами, этот принцип применим к равновесию любой природы: механическому, тепловому, химическому, электрическому, социальному. Согласно этому принципу, если система находится в состоянии равновесия, то любое воздействие,
которое выражается в изменении одного из факторов, определяющих равновесие, вызывает в ней изменение, стремящееся ослабить это воздействие.
Рассмотрим использование этого принципа и использование закона действующих масс для различных случаев сдвига химического равновесия.
