
Дист лекции Кудряшов / Растворы2
.pdf
Идеальные растворы
С точки зрения термодинамики раствор является идеальным или совершенным, если для каждого из компонентов выполняются три
следующих независимых условия: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
1. |
Парциальная мольная внутренняя энергия i-того |
|
компонента |
не |
||||||||||||
|
зависит от концентрации и равна мольной внутренней энергии чистого |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
i-того компонента. |
= (T,P); |
= - |
=0; |
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
2. |
Парциальный мольный объём |
i-того компонента |
|
|
|
не зависит |
от |
|||||||||
|
|
|
||||||||||||||
концентрации и равен мольному объему чистого i-того компонента.
= (T,P); = =0;
3. Парциальная мольная энтропия i-того компонента при растворении возрастает на такую же величину, как и при образовании идеальных
газовых растворов . - (T,P)= - Rlnxi.
Растворы, для которых не выполняется хотя бы одно из этих условий, называются неидеальными. Приведенные соотношения выполняются для идеальных растворов при всех концентрациях. Поэтому в качестве стандартного состояния удобно выбрать состояние чистых компонентов при данных T и P. В этом случае химический потенциал идеального раствора будет определяться ранее введенной формулой:
|
( |
|
|
)= |
|
|
(T,P)+ = |
(T,P)+ |
|
|
P |
|
- T |
|
= |
(T,P)+ RTlnxi |
||||||||||||||||||
|
Полученное |
соотношение |
показывает, |
что |
при |
всех |
концентрациях |
|||||||||||||||||||||||||||
|
, |
|
|
. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
Термодинамические свойства 1 моля идеального раствора и |
|||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
функции смешения. |
|
|
|
|
||||||||||||
1. |
Мольный объем идеального раствора: |
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
Vm=x1 |
|
+ x2 |
|
= x1 |
+ x2 |
|
|
+ x2( - |
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
VM=V-( x1 + x2 )=0. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
Таким образом, объем идеального раствора равен сумме объемов |
|||||||||||||||||||||||||||||||||
|
смешиваемых компонентов, а изменение объема при образовании моля |
|||||||||||||||||||||||||||||||||
|
идеального раствора равно 0. |
|
|
|
|
|
|
|
||||||||||||||||||||||||||
2. |
Мольная энтальпия идеального раствора: |
|
|
|
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
Hm= x1 |
|
+ x2 |
|
|
= x1 |
|
+ x2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
HM= H-(x1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
+ x2 |
)=0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
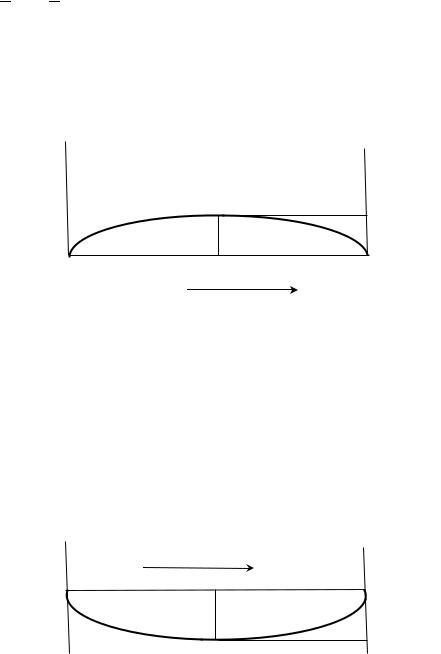
Другими словами энтальпия идеального раствора аддитивно |
||||||||||||||||||
|
складывается из энтальпий компонентов, а образование идеального |
||||||||||||||||||
|
раствора не сопровождается тепловым эффектом. |
||||||||||||||||||
3. |
Мольная внутренняя энергия идеального раствора: |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Um= x1 |
|
|
+ x2 |
|
|
= x1 |
|
|
+ x2 |
|||||||||
|
UM= U-(x1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
+ x2 |
)=0. |
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
Т.е. внутренняя энергия идеального раствора аддитивно складывается |
||||||||||||||||||
|
из внутренних энергий компонентов. |
||||||||||||||||||
4. |
Мольная энтропия идеального раствора: |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
Sm= x1 |
|
+ x2 |
|
= (x1 |
|
|
|
+ x2 ) - R(lnx1+ lnx2) |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
SM= S-(x1 + x2 )= - R(lnx1+ lnx2)= - R[ln(1-x2)+ lnx2]>0
Последнее уравнение показывает, что энтропия смешения одного моля идеального жидкого раствора не зависит от химической природы компонентов и представляет собой универсальную положительную функцию состава.
SM |
|
|
|
|
Rln2 |
1 |
0,5 |
2 |
|
x2 |
|
Продифференцировав последнюю функцию по x2 и приравняв производную к нулю можно определить состав (x2=0,5), при котором энтропия имеет максимальное значение (SM= Rln2).
5. Мольная энергия Гиббса идеального раствора:
Gm= x1 + x2 |
= (x1 |
+ x2 ) - RT(lnx1+ lnx2) |
|
GM= G - (x1 |
+ x2 |
) = RT(lnx1+ lnx2)= RT[ln(1-x2)+ lnx2]<0 |
|
|
GM |
x2 |
0,5 |
|
|
|
|
|
1 |
|
2 |
|
|
|
RTln2 |
Т.е. как и энтропия смешения, энергия Гиббса смешения одного моля раствора не зависит от химической природы компонентов и представляет собой универсальную отрицательную функцию состава.
Вывод: Т.к. VM=0, HM=0, SM>0, то единственной причиной образования жидкого идеального раствора является именно это возрастание энтропии (GM= - Т SM).
В каком случае VM=0, HM=0, т.е. когда образуются идеальные растворы? Когда частицы растворителя и растворенного вещества близки по своему строению, своим физическим и химическим свойствам. Это могут быть смеси изотопов, близких гомологов, оптических изомеров.
Равновесие идеальный раствор-пар. Закон Рауля.
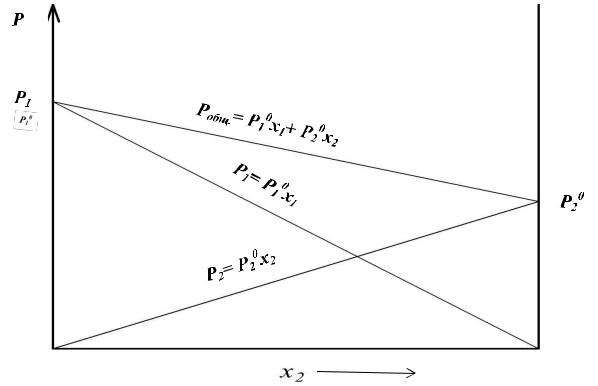
В конце 19-го века французский химик Ф.А. Рауль, исследуя разбавленные растворы органических и неорганических соединений, установил количественную связь между давлением насыщенного пара растворителя и его мольной долей в растворе:
|
|
|
|
1 |
1 x1 , |
|
|
|
|
|
|
|
|
|
P |
P |
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
где |
i |
давление |
насыщенного |
пара |
растворителя над |
|
раствором, |
1 - |
||
|
P |
|
|
|
|
|
|
|
|
P |
|
|
|
|
|
|
|
|
|
|
0 |
давление насыщенного пара над чистым растворителем, |
x1 |
- |
мольная доля |
|||||||
растворителя. |
|
|
|
|
|
|
|
|
||
|
В |
1890 г. |
И.Ф. Шредер |
выдвинул представление |
о растворах, |
|||||
подчиняющихся закону Рауля при всех концентрациях, и предложил рассматривать их как некоторый стандарт. В дальнейшем такие растворы получили название «идеальных» или «совершенных».
Изучение растворов показало, что их свойства в значительной мере определяются характером межмолекулярных взаимодействий. При этом решающую роль играет соотношение между однородными и разнородными частицами, т.е. между молекулами растворенного вещества и растворителя:
ε1-1; ε1-2; ε2-2.
В идеальных растворах, в отличие от идеального газа между молекулами существует взаимодействие, но
ε1-1≈ε1-2≈ ε2-2.
Исходя из этого условия, естественно предположить, что условия испарения компонентов из жидких растворов не должны отличаться от испарения индивидуальных жидкостей.
С точки зрения термодинамики закон Рауля можно обосновать на основе равенства химических потенциалов i-тых компонентов сосуществующих паровой и жидкой фаз. Очевидно, химический потенциал i-
того компонента жидкого раствора |
i,пар |
будет равен химическому |
потенциалу пара этого компонента i ,ж над раствором: |
||
i, пар i, ж , |
|
|
Будем считать, что пар подчиняется законам идеального газа. Тогда:
|
0 |
|
|
|
|
0 |
(P,T ) RT ln xi , а |
|
|
|
i, п (Т ) RT ln Рi = i,ж |
|
|||||||
|
|
|
|
|
|
|
|
. |
|
|
|
|
|
|
|
|
|
|
|
Если в области невысоких давлений считать, что |
не зависит от |
||||||||
давления, т.е. |
является только функцией температуры |
= f(T) , то правая |
|||||||
часть полученного соотношения |
при |
Т = const, является постоянной |
|||||||
величиной: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
const, |
|
или |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
= const |
|
||
При =1 |
(давление насыщенного пара чистого компонента). |
||||||||
Т.о. |
|
|
|
|
|
|
|
|
|
Полученное соотношение является выражением закона Рауля, которое было приведено нами ранее только для растворителя. В идеальных растворах закон Рауля соблюдается для любого компонента.
Формулировка закона Рауля:
Парциальное давление насыщенного пара компонента над раствором равно его мольной доле в растворе, умноженной на давление насыщенного пара над чистым компонентом.
1 |
2 |
|
|
Следует учесть, что это соотношение приближенное, т.к. мы исключили зависимость i-того компонента химического компонента от давления. Отклонения поведения идеального раствора от закона Рауля становятся заметными, если разность между давлениями паров чистых компонентов достаточно велика (давления отличаются в разы). Общее давление пара раствора в этом случае будет меньше, чем давление пара раствора, которым обладал бы раствор, если бы закон Рауля соблюдался строго. При этом компонент, обладающий меньшим давлением насыщенного пара над чистым компонентом, дает более высокие давления насыщенных паров над раствором, чем давление пара раствора, которым обладал бы раствор, если бы строго соблюдался закон Рауля (положительные отклонения от идеальности). Компонент, обладающий большим давлением насыщенного пара над чистым компонентом, дает меньшие давления насыщенных паров над раствором, чем давление пара раствора, которым обладал бы раствор, если бы строго соблюдался закон Рауля (отрицательные отклонения от идеальности).
Предельно разбавленные растворы. Закон Генри.
Рассмотрим теперь кратко закономерности, которым подчиняется давление пара в разбавленных растворах. Разбавленными растворами называют растворы, в которых концентрации всех растворенных веществ xi (i≥2) много меньше концентрации растворителя x1: x1>>xi, xi≈1. Предельно разбавленными растворами называются растворы, в которых концентрации растворенных веществ стремятся к нулю: xi →0 (i≥2). В 1802 г. В. Генри, изучая растворимость газов в воде, обнаружил, что количество газа, поглощаемого водой, увеличивается прямо пропорционально давлению газов на поверхность воды. Многочисленные исследования показали, что закон Генри справедлив во всех случаях, когда раствор является достаточно разбавленным и когда молекулярное состояние газа при растворении не изменяется, т.е. нет химического взаимодействия между молекулами растворителя и растворенного вещества.
В современной терминологии закон Генри формулируется следующим образом:
Парциальное давление пара растворенного вещества пропорционально его мольной доле в растворе:
(i≥2),
где KГi=KГi(Т,Р) называется постоянной Генри или коэффициентом Генри.
Рассмотрим зависимость химического потенциала i-того компонента от
ln xi
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
беск разб |
|
|
|
|
|
|
|
оло |
|||
|
|||||
раствор |
|
|
|
|
|
0 |
отр |
||||
∞ |
|
|
|
|
|
|
|
||||
|
|
||||
|
|
|
|
|
|
В предельно разбавленном растворе из-за малой концентрации в ближайшем окружении каждой молекулы растворителя практически отсутствуют молекулы растворенного вещества и энергетическое состояние молекул растворителя практически не отличается от такового в чистом растворителе. Поэтому предельно разбавленный раствор в отношении растворителя можно считать идеальным.
В области предельно разбавленного раствора для растворителя соблюдается закон Рауля:
|
|
|
|
|
|
|
P |
P |
0 |
x |
, |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
1 |
|
|
1 |
1 |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
и для него в этой области соблюдаются следующие соотношения:, , |
|
|
|||||||||||||||||||||
0 |
|
H |
|
0, H |
|
H |
0 |
|
S |
|
S |
0 |
R ln x |
|
|
|
|
V |
V |
0 |
|
||
RT ln x1 , |
|
|
|
, |
|
|
, |
V1 0, |
|
. |
|||||||||||||
1 1 |
|
1 |
|
1 |
|
1 |
|
1 |
|
|
|
1 |
1 |
1 |
|
1 |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Молекулы растворенного вещества, начиная с некоторой достаточно малой концентрации, также в ближайшем окружении имеют только молекулы растворителя, и их энергетическое состояние определяется только
энергией взаимодействия 1 2 , которая не равна энергии взаимодействия в
чистом втором компоненте |
|
1 2 |
|
2 2 |
. Таким образом, энергетическое |
|
|
состояние второго компонента не соответствует его состоянию в идеальном растворе и для него не применимы соотношения, справедливые для растворителя.
|
|
0 RT ln x |
|
, |
P0 |
P0 x |
|
, |
|
|
|
|
H 02 , S |
|
S 02 R ln x |
|
, |
|
|
|
|
|
V |
02 |
|
2 |
2 |
2 |
H |
2 |
2 |
2 |
V |
2 |
|||||||||||||||||
|
2 |
|
2 |
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|||||||||
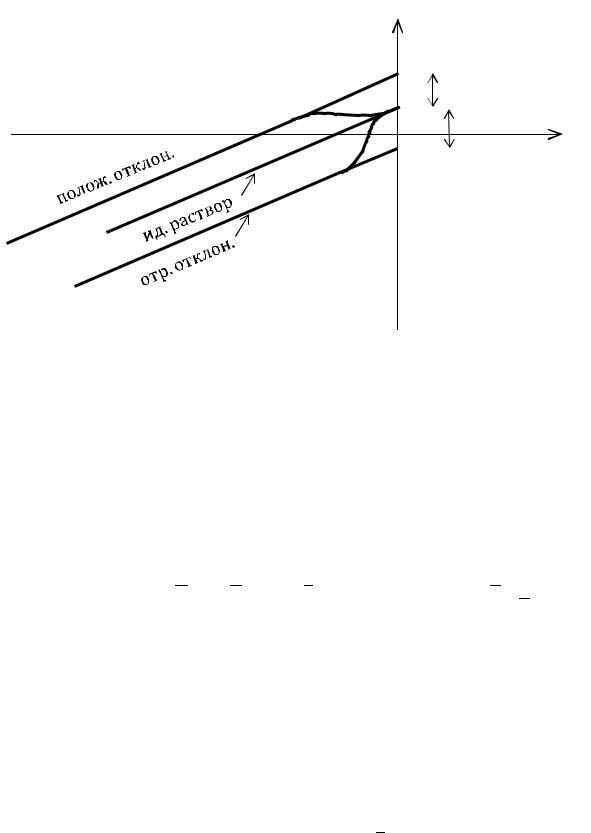
По зависимости |
=f( |
|
), |
приведенной выше на рис. мы видим, что |
|||||||||||||||||||||
в области высоких разбавлений |
( |
|
|
|
= - ∞) эта |
зависимость |
приобретает |
||||||||||||||||||

линейный характер, аналогичной зависимости для идеального раствора. Чтобы получить уравнение этой прямой, продолжим ее до пересечения с осью ординат. Отметим на оси точку пересечения . Тогда получим следующее соотношение:
i i* (T , P) RT ln xi .
Таким образом, мы получили величину с которой можно сравнивать
|
i |
|
. Совершенно ясно, что то не реальное, а некоторое гипотетическое
состояние. Это состояние соответствует состоянию вещества в растворе единичной концентрации, но обладающим свойством предельно
разбавленного. Гипотетичность раствора заключается в величине i |
i |
i |
|
* |
0 |
Следует отметить еще, что при добавлении чистого растворителя к предельно разбавленному раствору не происходит изменения объема и
.
энтальпии. При добавлении растворенного вещества такие изменения происходят.
С точки зрения термодинамики закон Генри можно обосновать с помощью второго закона Гиббса-Дюгема, установив связь между давлением пара растворителя и пара растворенного вещества при постоянной температуре:
x d |
1 |
x |
d |
2 |
|
||
1 |
|
2 |
|
|
|||
|
|
|
|
0 |
|
||
|
|
|
|
|
|
|
|
|
|
i,пар |
|
i ,пар |
|||
0
.
RT ln
Pi
,
Отсюда, продифференцировав последнее выражение для растворителя и растворенного вещества, получим:
d ln P2
x1 x2
d ln P 1
|
x dP |
|
x |
|
P 0 dx |
|
dx |
|
d (1 x ) |
||||||
|
1 |
1 |
|
|
1 |
1 |
1 |
|
|
1 |
|
|
1 |
||
x |
P |
x |
2 |
|
P 0 x |
x |
2 |
x |
2 |
||||||
|
|
|
|
|
|||||||||||
|
|
2 |
1 |
|
|
1 |
1 |
|
|
|
|
||||
|
dx |
2 |
d ln x |
|
|
|
|
|
|||
x |
|
|
2 |
||
|
|
|
|
||
|
2 |
|
|
||
|
|
|
|
||
ln P2
ln x |
2 |
|
const , |
|
где |
|
P |
= K |
Г |
x |
2 |
|
2 2 |
|
const K |
Г |
|
,
Константу Генри
x2 0 .
K Г
|
|
|
|
|
|
|
|
|
P |
|
f x2 |
|
|
находят экстраполяцией зависимости |
2 |
|
при |
||||||||||
x |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
K |
|
|
lim |
P |
|
|
|
|
|
|
|||
Г |
2 |
2 |
x |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
x |
2 |
0 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
||
Для идеального раствора K Г 2 P20 и закон Генри превращается
в закон Рауля.
Уравнение для химического потенциала для растворенного вещества:
|
2 |
ст RT ln x |
2 |
* RT ln x |
2 |
* RT ln P K |
Г |
. |
|
|
2 |
2 |
2 |
2 |
|
||||
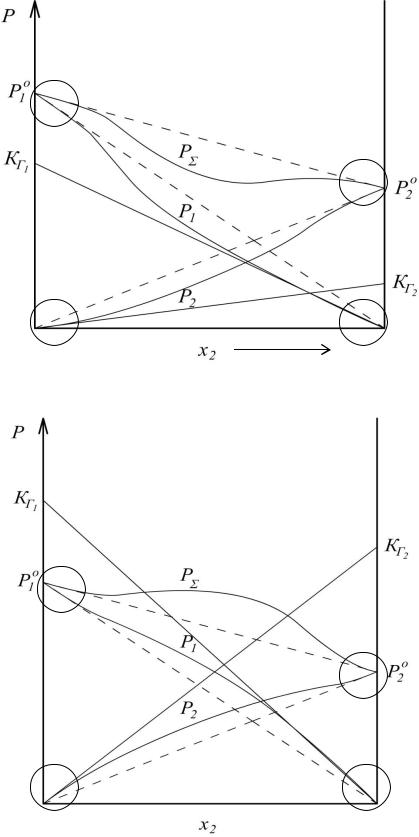
Выполнение закона Рауля для растворителя и закона Генри для растворённого вещества иллюстрируют следующие два рисунка:
I
I
II
II
1 |
2 |
А) Отрицательные отклонения от идеальности.
I
I
II |
II |
1 |
2 |
Б) Положительные отклонения от идеальности.
В областях для растворителя, отмеченных кружками с латинской цифрой I наблюдается хорошее совпадение с законом Рауля (тонкая пунктирная прямая линия). Для растворенного вещества, в областях, отмеченных кружками с латинской цифрой II, наблюдается хорошее совпадение с законом Генри (тонкая сплошная прямая линия).
Для реальных растворов линии на графиках зависимости парциальных давлений паров компонентов и общего давления от мольной доли компонента не являются прямыми. Такие отклонения этих линий от прямых закона Рауля называют «отклонениями от закона Рауля». На молекулярном уровне отклонения от идеальности объясняют, прежде всего, различием энергий межмолекулярного взаимодействия. Если силы притяжения между однородными молекулами в растворе больше, чем между молекулами разных компонентов, то при образовании такого раствора облегчается способность перехода компонентов в пар. При этом равновесные парциальные давления паров компонентов над раствором будут больше, чем вычисленные по закону Рауля (положительные отклонения от идеальности). Рис. Б в средней части.
P > P |
0 |
x |
|
|
|
i |
|||
i |
i |
|
|
|
А если силы притяжения между однородными молекулами в растворе меньше, чем между молекулами разных компонентов, то при образовании такого раствора способность перехода компонентов в пар снижается. При этом парциальные давления паров компонентов будут меньше вычисленных по закону Рауля (отрицательные отклонения от идеальности).
P < P |
0 |
x |
|
|
|
i |
|||
i |
i |
|
|
|
В пределе большие положительные отклонения от идеальности сопровождаются образованием в растворах кластеров однотипных молекул и могут привести к расслаиванию раствора на две различных фазы. Большие отрицательные отклонения от идеальности приводят к образованию в растворах ассоциатов (непрочных соединений) разноимённых частиц.
Итак, мы рассмотрели переход растворенного вещества из фазы в фазу. Рассмотрим теперь и переход растворителя из фазы в фазу. Рис. А в средней части.
Особенности свойств разбавленных растворов нелетучих веществ в летучем растворителе. Коллигативные свойства.
Коллигативные свойства в переводе с греческого это коллективные свойства, т.е. свойства, зависящие от числа молекул. Коллигативные свойства зависят только от природы растворителя и от

концентрации вещества в растворе (числа частиц в единице объема), но не зависят от свойств этих частиц. К ним относятся:
относительное понижение давления пара растворителя над раствором; повышение температуры кипения раствора по сравнению с чистым
растворителем; понижение температуры замерзания раствора по сравнению с чистым
растворителем; осмотическое давление.
Сделаем три предположения:
A)Растворенное вещество нелетучее. (Нелетучими веществами считают такие вещества, у которых давление насыщенного пара ничтожно мало
по сравнению с давлением насыщенного пара растворителя или вещество, у которого температура кипения приблизительно на 1500С, чем температура кипения растворителя.).
B)Растворенное вещество не растворяется в чистом растворителе.
C)Раствор разбавлен: x1 >>x2.
Относительное понижение давления пара растворителя над раствором.
Если растворенное вещество нелетуче, то пар над раствором будет содержать только пары растворителя. Для таких растворов закон Рауля применим только к растворителю.
P P |
0 |
x |
|
|
|||
1 |
1 |
1 |
|
Так как x1 = 1- x2, то
P P |
0 |
(1 x |
|
) |
|
|
2 |
||||
1 |
1 |
|
|
||
Раскрывая скобки, получим закон Рауля в несколько иной форме:
Из этого уравнения следует, что относительное понижение давления насыщенного пара растворителя над раствором зависит только от концентрации растворенного вещества, но не зависит от его природы.
Из закона Рауля для растворов нелетучих веществ в летучих растворителях вытекают важные закономерности, связанные с температурой кипения и затвердевания разбавленных растворов.
