
4. Химическая кинетика и равновесие
Химическая кинетика – раздел химии, изучающий скорости и механизмы химических реакций.
Скоростью химической реакции называют изменение концентрации вещества за единицу времени в единице реакционного пространства. Скорость реакции зависит от природы реагирующих веществ и условий протекания реакции: концентрации реагентов, температуры и присутствия катализатора (для реакции с участием твёрдых веществ зависит также от степени их измельчения). Для газов скорость реакции зависит и от давления, так как в этом случае с изменением давления изменяется концентрация реагентов.
Зависимость скорости реакции от концентрации реагирующих веществ выражается законом действия масс (з. д. м.): при постоянной температуре скорость химической реакции пропорциональна произведению концентраций реагирующих веществ в степени, равной коэффициенту, стоящему перед фор-мулой данного вещества в уравнении реакции.
Для уравнения химической реакции в общем виде
aA + bB + …= cC + dD
закон действия масс можно записать V = k[A] a[B] b…,
где k − константа скорости химической реакции.
Реакция, протекающая в одной фазе (однородной среде), называется гомогенной, реакция, протекающая на границе раздела фаз, например твердой и жидкой, твердой и газообразной, называется гетерогенной.
Например, для гомогенной химической реакции
N![]() +3H
+3H
![]() 2NH
2NH![]() ;
V
= k[N
][H
]3.
;
V
= k[N
][H
]3.
В случае гетерогенных реакций в уравнение закона действия масс входят концентрации только тех веществ, которые находятся в газовой фазе или в растворе.
Например:
![]() ;
V
= k[O
].
;
V
= k[O
].
Возрастание скорости химической реакции с ростом температуры выражается правилом Вант-Гоффа: повышение температуры химической реакции на 10° увеличивает скорость в 2-4 раза.
V
=
V![]() γ
γ![]() ,
,
где V − скорость химической реакции при температуре T ; V − скорость химической реакции при температуре T ; γ − температурный коэффициент скорости химической реакции.
Между скоростью протекания реакций и их продолжительностью существует обратно пропорциональная зависимость:
 ,
,
где t1 и t2 – время протекания реакции при температурах T1 и T2. Тогда по правилу Вант-Гоффа
 .
.
Каждая химическая реакция характеризуется определенным энергетическим барьером, который преодолевают молекулы, чтобы вступить в реакцию и образовать новые вещества. Для преодоления этого барьера молекулам нужна дополнительная энергия – энергия активации.
Зависимость константы скорости химической реакции от температуры определяется уравнением Аррениуса:
 ,
(5)
,
(5)
где
![]() ,
,
![]() – константы скорости реакции при
температурах Т1 и Т2;
– константы скорости реакции при
температурах Т1 и Т2;
R – универсальная газовая постоянная, 8,31 Дж/(мольК); Еa – энергия активации, кДж/моль.
Из уравнения (5) находим энергию активации:
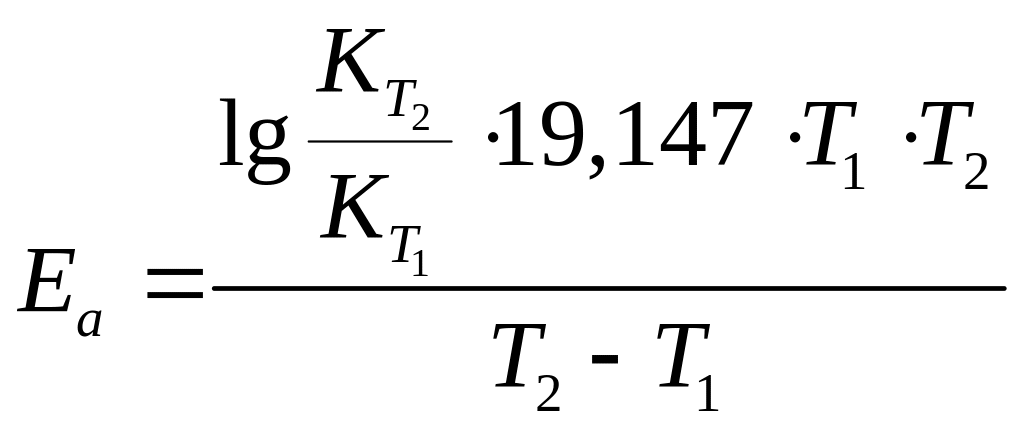 .
.
Многие химические реакции протекают обратимо, т. е. идут не до конца. В реакционной смеси при обратимых процессах всегда остаётся (в боль-шем или меньшем количествах) каждое из исходных веществ. К числу обратимых, например, относятся следующие реакции:
1. H2(г) + I2(г) 2HI(г) гомогенная реакция;
2. 3H2(г) + N2(г) 2NH3(г) гомогенная реакция;
3. CaCO3(к) CaO(к) + CO2(г) гетерогенная реакция.
Реакцию,
протекающую слева направо (![]() ),
называют прямой, справа налево (
),
называют прямой, справа налево (![]() )
− обратной.
)
− обратной.
При равновесии скорости прямой и обратной реакций равны, а отношение констант скоростей называется константой равновесия данной системы. Для гомогенной реакции 3H2(г) + N2(г) 2NH3(г)
![]() .
.
Для
гетерогенной химической реакции,
например, реакции разложения карбоната
кальция СaCO3(к)
CaO(к) + CO2(г),
![]() ,
так как скорость химической реакции не
зависит от концентрации твердой фазы.
,
так как скорость химической реакции не
зависит от концентрации твердой фазы.
Смещением или сдвигом химического равновесия называют изменение равновесных концентраций реагирующих веществ в результате изменения одного из условий реакции. Направление смещения равновесия определяется принципом Ле Шателье: если на систему, находящуюся в равновесии, оказывать внешнее воздействие, то равновесие смещается в том направлении, которое ослабляет эффект внешнего воздействия.
При повышении температуры равновесия смещаются в сторону поглощения тепла, то есть в сторону эндотермической реакции. При увеличении концентрации исходных веществ равновесие смещается в правую сторону, а при увеличении концентрации продуктов реакций – в левую. При повышении давления равновесие смешается в сторону образования меньшего числа молей газообразных веществ, и, наоборот, при понижении давления равновесие смещается в сторону образования большего числа молей газообразных веществ.
Пример 1. Реакция протекает согласно уравнению А + 2В = С; концентрация вещества А = 0,5 моль/л, а вещества B = 2 моль/л. Константа скорости равна k = 0,5 л2моль-2с-1. Вычислить скорость реакции в начальный момент и когда останется 30 % вещества А. Во сколько раз изменяется скорость прямой и обратной реакций в системе, если увеличить давление в два раза?
Решение. Согласно з. д. м. V = kCA CB2.
Скорость реакции в начальный момент
V1 = 0,50,522 = 1,0 моль/лс.
Когда останется 30 % вещества А, концентрация его станет 0,5 0,30 =
= 0,15 моль/л. Значит, концентрация вещества А уменьшится на 0,5 – 0,15 =
= 0,35 моль/л. Так как вещества А и В взаимодействуют между собой в соотношении 1:2, то концентрация вещества В уменьшилась на 0,7 моль/л (0,352) и стала равной 1,3 моль/л (2 – 0,7). Следовательно,
V2 = 0,50,15(1,3)2 = 0,13 моль/ лс.
Увеличение давления в системе в 2 раза вызовет уменьшение объема в два раза, а концентрация вещества возрастает в 2 раза. Согласно з. д. м. начальная скорость прямой реакции
Vпр = kпрCA CB2,
после увеличения давления скорость станет
Vпр = kпр·(2CA)·(2CB)2= 8·kпр·(2CA)·(2CB)2.
После увеличения давления в два раза скорость прямой реакции возросла в 8 раз. Скорость обратной реакции по з.д.м. в начальный момент
Vоб = kоб·CC ,
после увеличения давления скорость станет Vоб = 2·CC. После увеличения давления в 2 раза скорость обратной реакции возросла в 2 раза.
Пример 2. При 323 К реакция заканчивается за 30 с. Сколько времени будет длиться реакция при 293 К, если температурный коэффициент этой реакции равен 2.
