
- •1.Організація контролю якості ліків у країні;
- •Функції
- •2. Організація аналітичної служби контрольно–аналітичних лабораторій і кабінетів;
- •Функції
- •3. Організація роботи місця провізора–аналітика;
- •4. Обладнання робочого місця провізора–аналітика;
- •5. Загальні фармакопейні методи аналізу лікарських засобів
- •6.Хімічні методи аналізу лікарських засобів;
- •7. Фізичні методи аналізу лікарських засобів
- •8. Приготування розчинів індикаторів
- •9. Що таке еталони, їх приготування
- •10. Приготування титрованих розчинів із фіксаналів
- •11. Приготування титрованих розчинів з наважки
- •12. Встановлення поправочного коефіцієнта
- •13. Етапи визначення доброякісності лз
- •14. Фармакопейні методи ідентифікації лікарських засобів
- •15. Експресні методи ідентифікації лікарських засобів
- •16. Кількісне визначення речовин методами нейтралізації
- •17.Кількісне визначення речовин методами кислотно–основного титрування в неводних середовищах Особливості титрування в неводних розчинах.
- •18. Кількісне визначення речовин методами аргентометрії
- •Метод Мора
- •19. Кількісне визначення речовин методами меркурометрії
- •20. Кількісне визначення речовин методами броматометрії
- •Застосування
- •Кількісне визначення речовин методами йодометрії;
- •Кількісне визначення речовин методами нітритометрії;
- •Кількісне визначення речовин методами йодатометрії;
- •Визначення вологи, зольності;
- •Визначення густини;
- •Визначення наявності спирту у настоях та екстрактах;
- •Визначення сухого залишку у настоях та екстрактах;
- •Визначення температури плавлення, кипіння,
- •Визначення вмісту азоту в органічних сполуках;
- •Рефрактометрія – основні засади методу
- •Поляриметрія - – основні засади методу;
- •Фотометрія - – основні засади методу;
- •Хроматографія – основні засади методу;
- •Визначення тотожності порошків;
20. Кількісне визначення речовин методами броматометрії
Брома́тометрі́я (рос. броматометрия, англ. bromatometry, bromometry, нім. Bromatometrie) — титриметричний метод кількісного аналізу для визначення відновників за допомогою реакції із титрованим розчином бромату калію.
присутності відновників бромат-іони відновлюються у кислому середовищі до бромід-іонів:
{\displaystyle \mathrm {BrO_{3}^{-}+6H^{+}+6e^{-}\longrightarrow Br^{-}+3H_{2}O} }
А в присутності бромідів бромати виділяють вільний бром:
{\displaystyle \mathrm {2BrO_{3}^{-}+5Br^{-}+6H^{+}\longrightarrow 3Br_{2}+3H_{2}O} }
Реакція проходить виключно у кислому середовищі. Кінцеву точку титрування визначають за появою жовтуватого забарвлення утвореного брому або за допомогою окисно-відновних індикаторів (метилоранжу, метилового червоного, індигокарміну) чи, для більшої точності, потенціометрично.
Застосування
Броматометрія застосовується для визначення сполук Fe+2, As+3, Sb+3, Sn+2, гідразину, гідроксиламіну.
Також метод застосовується при визначенні деяких органічних сполук, що здатні заміщувати або приєднувати бром, наприклад, фенолу, аніліну, крезолу, резорцину:
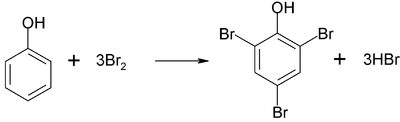
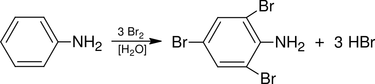
При зворотньому броматометричному титруванні надлишок утвореного брому відтитровують розчиному тіосульфату натрію у присутності йодиду калію та крохмалю як індикаторів.
Інколи до броматометрії також відносять метод, за яким в вихідний досліджуваний розчин попередньо додається розчин броміду калію (бромід-броматометрія)
-
Кількісне визначення речовин методами йодометрії;
ЙОДОМЕТРІЯ — титриметричний метод визначення окисників і відновників, що базується на використанні окисних властивостей розчину I2 та відновних властивостей розчину Na2S2O3
Титранти — 0,05 М розчин I2 в розчині KI та 0,05 М розчин Na2S2O3, стабілізований HgI2. Розчини титрантів зберігають у темному місці. Для стандартизації використовують: для розчину I2 — речовини As2O3, N2H4·H2SO4 або стандартний розчин Na2S2O3; для розчину Na2S2O3 — речовини K2Cr2O7, KBrO3 або стандартні розчини I2, KMnO4, KBrO3. Умови титрування — слабкокисле, нейтральне або слабколужне середовище. При визначенні відновників титрують розчином І2.
Кінцеву точку титрування визначають за появою світло-жовтого забарвлення розчину від однієї зайвої краплі титранту; для підвищення чутливості визначення кінцевої точки титрування до розчину, що титрують, додають невелику кількість органічного розчинника, який забарвлюється у рожевий колір (безіндикаторний метод).
Як індикатор використовують розчин крохмалю, який від однієї зайвої краплі титранту забарвлюється у синій колір.
-
Кількісне визначення речовин методами нітритометрії;
НІТРИТОМЕТРІЯ — титриметричний метод, що базується на діазотувальних (1) та нітрозувальних (2) властивостях азотистої кислоти, а також на окисно-відновних (3,4) властивостях нітритів лужних металів за схемами:
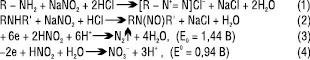
Метод використовують для визначення первинних ароматичних амінів
Титрування проводять у кислому середовищі. Кінцеву точку титрування визначають за допомогою аміноантрахінонових барвників (тропеоліну 00, сафранілу) як індивідуально, так і в суміші з метиленовим синім. Застосовують також йодкрохмальний папір як зовнішній індикатор. Кінцеву точку титрування визначають також потенціометрично та амперометрично. Титрант — 0,1 М розчин NaNO2
