
- •Синтез 2-нафтолоранжевого красителя
- •1. Общие положения
- •1.Восстановление солей диазония в арилгидразины
- •2. Реакции сочетания
- •2. Синтез заданного органического соединения
- •3. Расчет количеств исходных веществ, необходимых для синтеза
- •3.1 Расчёт основных исходных веществ
- •3.2 Расчет количества вспомогательных веществ
- •4. Теоретический выход целевого продукта (в граммах)
- •5. Ожидаемый выход целевого продукта ( в граммах и в процентах от теоретического выхода)
- •6. Описание хода синтеза
- •6.1 Диазотирование
- •Азосочетание
- •Ледяное крашение
- •Список использованных источников
2. Синтез заданного органического соединения
2.1 Уравнения основных реакций
а) Диазотирование

б) Азосочетание
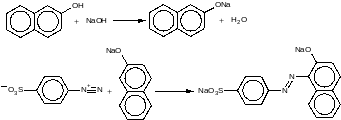
2.2 Свойства синтезируемого вещества по литературным данным
молекулярная масса = 137
tкип = 2860С
tпл = 1230С
Растворимость в 100г воды 0,07420
Растворимость в органических растворителях: растворим в хлороформе, этаноле, эфире
Таблица 2.3 – Свойства основных исходных соединений
Формула |
Молярная масса г*моль-1 |
tпл 0С
|
tкип 0С |
d420 |
nD20 |
Растворимость |
|
C10H8O |
137 |
123 |
286 |
1.2800 |
---- |
в воде |
в орг. растворит. |
|
|
|
|
|
|
0.07420 |
р. эт; эф, хлф |
C6H7NO4 |
169 |
288 |
разл. |
1,4850 |
1,4850 |
6,7100 |
м.р. эт; н.р. эф |
NaNO2 |
69 |
271 |
разл. |
2,17 |
|
82,9 |
х.р. эт, пир, ж. NH3 |
3. Расчет количеств исходных веществ, необходимых для синтеза
Дано:
Основные
4,3 г. сульфаниловая кислота
2,1 г. натрий азотистокислый
3,6 г.нафтол-2
Вспомогательные
едкий
натр, 2н раствора 12,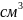
соляная кислота, 2н раствора 12,
едкий натр(порошок) 2г
натрий хлорид 25 г
Рассчитать количество моль исходных веществ, исходя из 4г нафтола-2
3.1 Расчёт основных исходных веществ
Находим количества молей (n)исходных веществ, исходя из данных МУ
Сульфаниловая кислота:
n= =
0,0254 моль
=
0,0254 моль
где: 4.3 г – масса сульфаниловой кислоты
169 – молярная масса сульфаниловой кислоты
– молярная масса сульфаниловой кислоты
Натрий азотистокислый:
n=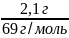 =
0,0304 моль
=
0,0304 моль
где: 2,1 г- масса натрия азотистокислого
 -
молярная масса натрия азотистокислого
-
молярная масса натрия азотистокислого
Нафтол-2 :
n= =
0,0263 моль
=
0,0263 моль
где: 3,6 г- масса нафтола-2
 -
молярная масса нафтола-2
-
молярная масса нафтола-2
Мольное соотношение реагентов :
сульфаниловая кислота: натрий азотистокислый: нафтол-2= 0,0254: 0,0304:0,0263
Делим все три числа на 0,0263 (число моль вещества, по которому ведется расчет); получаем новое мольное соотношение: 0,97:1,16:1
Сохраняя это мольное соотношение, находим количество молей, массы реагирующих веществ, исходя из выданных по заданию 4 г.нафтола-2.
Рассчитаем
n(нафтола-2)
= =0,0277
моль
=0,0277
моль
Найдем
n( )
и m(
)
)
и m(
)
n( )=0,0277 моль *1,16 моль =0,032 моль
m( )= n( )* M( )= 0,032 моль* 69 =2,22 г
Найдем n(сульфаниловой кислоты) и m(сульфаниловой кислоты)
n(сульфаниловой кислоты)=0,097 моль *0,0277 моль =0,0269 моль
m(сульфаниловой кислоты)= 0,0269 моль* 173 =4,7 г
3.2 Расчет количества вспомогательных веществ
Расчет количества вспомогательных веществ рассчитываем по пропорции, исходя из заданного количества исходного вещества.
В
данном синтезе в качестве вспомогательных
веществ применяются едкий натр 2н р-р
12,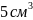 ,
соляная кислота 2н р-р 12,
,едкий
натр(порошок) 2г,натрий
хлорид 25 г.
,
соляная кислота 2н р-р 12,
,едкий
натр(порошок) 2г,натрий
хлорид 25 г.
Из условия методики данного синтеза известно, что
для
3,6 нафтола-2 необходимо 12,5
нафтола-2 необходимо 12,5 ,
,
а
для 4 г.нафтола-2 -x тогда
тогда
 =
(4 г*12,5
)/3,6
г = 13,89
=
(4 г*12,5
)/3,6
г = 13,89
для 3,6 нафтола-2 необходимо 12,5 ,
а для 4 г. нафтола-2 - x тогда
 =
(4 г*12,5
)/3,6
г = 13,89
=
(4 г*12,5
)/3,6
г = 13,89
для
3,6
нафтола-2 необходимо 2 г.
 ,
,
а для 4 г. нафтола-2 - x тогда
 =
(4 г*2 г)/3,6 г = 2,2 г.
=
(4 г*2 г)/3,6 г = 2,2 г.
для 3,6 нафтола-2 необходимо 25 г.NaCl,
а
для 4 г. нафтола-2 - x тогда
тогда
 =
(25 г*4 г)/3,6 г = 27,78 г.
=
(25 г*4 г)/3,6 г = 27,78 г.
Таким образом, для синтеза 2-нафтолоранжевого красителя необходимо:
4 г нафтола-2,
2,2 г натрия азотистокислого,
4,7 г сульфаниловой кислоты,
13,89 см3 едкого натра,
13,89 см3 соляной кислоты,
2,2 г едкого натра (порошок),
27,78 г хлористого натрия.
Запишем новое мольное соотношение: сульфаниловая кислота: натрий азотистокислый: нафтол-2=0,0269:0,032:0,0277
