
- •Лабораторная работа № 3 термодинамика химического равновесия процессов комплексообразования Равновесия в водных растворах комплексных соединений
- •Задание к работе
- •Оборудование и реактивы
- •Экспериментальная часть
- •3.7. Теоретические вопросы
- •Второй закон термодинамики. Термодинамические потенциалы
- •Энтропия.
- •Расчет изменения энтропии для различных процессов. Третий закон термодинамики
- •Расчет изменения энтропии процессов расширения и сжатия идеального газа при различных условиях
- •Характеристические функции. Вывод уравнений Максвелла. Термодинамические потенциалы
- •Расчет изменения энергии Гиббса и Гельмгольца для различных процессов
- •Зависимость термодинамических потенциалов от состава. Химический потенциал
- •Лабораторнаяработа № 2 исследование температурной зависимости термодинамических функций на примере реакции нейтрализации Теплота нейтрализации
- •Задание к работе
- •Оборудование и реактивы
- •Экспериментальная часть
- •Теоретические вопросы
Расчет изменения энергии Гиббса и Гельмгольца для различных процессов
Изменение энергий Гиббса и Гельмгольца при изменении температуры
Температурная зависимость энергий Гиббса и Гельмгольца от температуры определяется соотношениями:
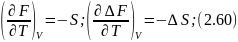
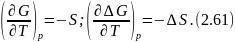
И в интегральной форме:


Изменение энергий Гиббса и Гельмгольца при изотермическом расширении или сжатии
Изменения энергий Гиббса и Гельмгольца при сжатии или расширении, когда Т = const, выражаются в дифференциальной форме уравнениями:


Для идеальных газов в интегральной форме:


Для конденсированных систем при умеренных давлениях

где
 –
объем конденсированной фазы.
–
объем конденсированной фазы.
Изменение энергий Гиббса и Гельмгольца при фазовых превращениях
Изменение
энергии Гиббса для фазовых переходов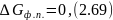
для
испарения и возгонки (р
= const)

для
плавления и полиморфных превращений

Изменение энергий Гиббса и Гельмгольца при химической реакции
Рассмотрим различные способы:
Изменение энергии Гиббса можно рассчитать, используя стандартные энергии Гиббса образования реагентов и продуктов:
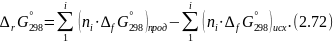
По определению, G = H – TS:

где
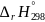 и
и
 рассчитываем
по уравнениям (1.16) и (1.18) соответственно.
рассчитываем
по уравнениям (1.16) и (1.18) соответственно.
При произвольной температуре изменение энергии Гиббса рассчитывают аналогично:

при этом температурные зависимости стандартной энтальпии и энтропии реакции определяются выражениями (1.26) и (2.25) соответственно.
Для расчета энергии Гиббса реакции удобно использовать так называемую приведенную энергию Гиббса или Ф-потенциал:


Приведенный потенциал имеет размерность [Дж·моль-1·К-1], численные значения этой функции для интересующего вещества при разных температурах можно найти в специализированных термодинамических справочниках. Для расчета стандартной энергии Гиббса реакции с помощью Ф-потенциала используют формулы:


Изменение энергии Гельмгольца химической реакции связано с энергией Гиббса соотношением
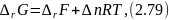
где Δn – изменение количества молей газообразных веществ в ходе реакции. Для реакций в конденсированной фазе эти две величины практически одинаковы

Зависимость термодинамических потенциалов от состава. Химический потенциал
При протекании химической реакции меняется число и вид частиц (молекул). Поэтому термодинамические потенциалы будут функциями не только своих естественных переменных, но и числа молей компонентов системы ni. Тогда энергия Гиббса есть функция G = f(T, р, n1, n2,…), полный дифференциал которой равен

Обозначим

Величина
 – называется химическим потенциалом
и представляет собой частную производную
термодинамических потенциалов по
количеству i-го
компонента при фиксированных естественных
переменных, т. е. он показывает, насколько
изменяется соответствующий термодинамический
потенциал при добавлении бесконечно
малого количества i-го
компонента к 1 молю раствора. Размерность
Дж/моль.
– называется химическим потенциалом
и представляет собой частную производную
термодинамических потенциалов по
количеству i-го
компонента при фиксированных естественных
переменных, т. е. он показывает, насколько
изменяется соответствующий термодинамический
потенциал при добавлении бесконечно
малого количества i-го
компонента к 1 молю раствора. Размерность
Дж/моль.
Одно и тоже значение химического потенциала i-го компонента можно получить из зависимостей от числа молей ni термодинамических потенциалов при постоянных естественных переменных:

С учетом введенных обозначений выражения для полных дифференциалов термодинамических потенциалов имеют вид:




Соответственно получаем

В выражении (2.88) знак равенства соответствует установлению термодинамического равновесия, знак «меньше» – самопроизвольному протеканию химической реакции.
Для того чтобы модно было использовать химический потенциал при решении практических задач, необходимо установить вид его зависимости от измеримых термодинамических переменных – температуры, давления и состава:
– Идеальные газовые смеси:

где
 –
стандартный химический потенциал i-го
газа, т. е. его потенциал в состоянии
чистого вещества при заданной температуре
и давлении 1 бар;
–
стандартный химический потенциал i-го
газа, т. е. его потенциал в состоянии
чистого вещества при заданной температуре
и давлении 1 бар;
 –
текущее парциальное давление газа.
–
текущее парциальное давление газа.
– Реальные газовые смеси:

где
 –
летучесть
или фугитивность
– давление, которое должна производить
реальная система, чтобы оказывать такое
же действие, как идеальная система;
–
летучесть
или фугитивность
– давление, которое должна производить
реальная система, чтобы оказывать такое
же действие, как идеальная система;
 –
коэффициент летучести используется
для характеристики отклонения от
идеального поведения.
–
коэффициент летучести используется
для характеристики отклонения от
идеального поведения.
– Идеальные конденсированные растворы:

где – мольная доля компонента в смеси.
– Реальные конденсированные растворы:

где
 –
активность, которая может быть представлена
в виде произведения мольной доли
компонента
на его коэффициент активности
–
активность, которая может быть представлена
в виде произведения мольной доли
компонента
на его коэффициент активности
 :
:

В нашем случае активность безразмерная величина. Также она может быть выражена через молярную или моляльную концентрации (активность будет иметь размерность концентрации), тогда будут изменяться значения коэффициентов активности.
Коэффициенты активности – безразмерные величины, они характеризуют работу, которую надо совершить при перемещении i-го компонента из идеального раствора в реальный при постоянной температуре, давлении и концентрации.
