
- •Лабораторная работа № 3 термодинамика химического равновесия процессов комплексообразования Равновесия в водных растворах комплексных соединений
- •Задание к работе
- •Оборудование и реактивы
- •Экспериментальная часть
- •3.7. Теоретические вопросы
- •Второй закон термодинамики. Термодинамические потенциалы
- •Энтропия.
- •Расчет изменения энтропии для различных процессов. Третий закон термодинамики
- •Расчет изменения энтропии процессов расширения и сжатия идеального газа при различных условиях
- •Характеристические функции. Вывод уравнений Максвелла. Термодинамические потенциалы
- •Расчет изменения энергии Гиббса и Гельмгольца для различных процессов
- •Зависимость термодинамических потенциалов от состава. Химический потенциал
- •Лабораторнаяработа № 2 исследование температурной зависимости термодинамических функций на примере реакции нейтрализации Теплота нейтрализации
- •Задание к работе
- •Оборудование и реактивы
- •Экспериментальная часть
- •Теоретические вопросы
Лабораторная работа № 3 термодинамика химического равновесия процессов комплексообразования Равновесия в водных растворах комплексных соединений
Комплексообразование – ступенчатый процесс, каждая ступень характеризуется константой равновесия, которая называется константой образования комплекса, часто используется термин константа устойчивости.
Так, например, в растворе, содержащем ионы Ag+ и Br–, имеют место следующие равновесия (для простоты в выражениях для равновесных концентраций квадратные скобки при написании формул комплексных частиц опускаются):
Ступень |
Равновесие |
Ступенчатая константа образования |
Значение ступенчатой константы |
I |
Hg2+
+ Br– |
|
1,12·109 |
II |
HgBr+ + Br– HgBr2 |
|
1,91·108 |
III |
HgBr2 + Br– HgBr3– |
|
26,3 |
IV |
HgBr3– + Br– HgBr42– |
|
18,1 |
К1, К2, К3, К4 – ступенчатые константы образования комплексов характеризуют способность комплексообразователя к последовательному присоединению лигандов.
Общая константа образования βn характеризует устойчивость комплекса [MLn] иравна произведению ступенчатых констант образования:

В
справочной литературе чаще указывается
значение lg .
.
В общем виде для комплекса [MLn]
M + nL [MLn].
Общая константа образования

Ступенчатая константа образования
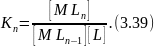
Легко показать, что

Процесс комплексообразования, как любой ступенчатый процесс, подчиняется общим закономерностям: каждая последующая ступень идет в меньшей степени, чем предыдущая и значения характеризующих их констант в большинстве случаев уменьшается. Это объясняется влиянием ряда факторов: а) возрастанием пространственных затруднений при увеличении числа лигандов, если они обладают большими размерами, чем молекулы воды; б) электростатическим расталкиванием в случае заряженных лигандов.
Соединения, включающие комплексный катион или анион, ведут себя в водном растворе как сильные электролиты (первичная диссоциация комплекса). При этом происходит необратимая диссоциация на комплексные ионы и ионы, составляющие внешнюю сферу, например:
K2[HgBr4] = 2K+ + HgBr42–.
Затем происходит вторичная диссоциация комплекса уже по типу слабого электролита – внутренняя сфера комплекса в водном растворе обратимо подвергается акватации. При этом лиганды последовательно замещаются на молекулы воды:
[MLn] + H2O [MLn –1(H2O)] + L
(заряды частиц опущены). Равновесная концентрация воды здесь – величина постоянная (вода – растворитель), поэтому при рассмотрении равновесий в водных растворах комплексов молекулы воды при записи часто опускают. Покажем на примере рассмотренного ранее комплекса последовательный поцесс акватации:
Ступень |
Равновесие |
Ступенчатая константа нестойкости |
IV |
[HgBr4]2– + H2O [HgBr3H2O]– + Br– упрощенно HgBr42– HgBr3– + Br– |
|
III |
[HgBr3H2O]– + H2O [HgBr2(H2O)2] + Br– упрощенно HgBr3– HgBr2 + Br– |
|
II |
[HgBr2(H2O)2] + H2O [HgBr(H2O)3]+ + Br– HgBr2 HgBr+ + Br– |
|
I |
[HgBr(H2O)3]+ + H2O [Hg(H2O)4]2+ + Br– HgBr+ Hg2+ + Br– |
|
Константы
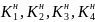 – называются ступенчатыми
константами нестойкости
(неустойчивости). Общая
константа нестойкости
равна произведению ступенчатых констант:
– называются ступенчатыми
константами нестойкости
(неустойчивости). Общая
константа нестойкости
равна произведению ступенчатых констант:

Данное выражение отвечает гипотетическому равновесию:
HgBr42– Hg2+ + 4Br–.
Константа образования – обратная величина константе нестойкости:

Чтобы ступенчатые константы образования и ступенчатые константы нестойкости соответствовали друг другу, нумерацию ступеней вторичной диссоциации комплексных частиц дают в обратном порядке.
Константы образования и нестойкости характеризуют устойчивость комплексных частиц: чем больше константа образования (меньше константа нестойкости), тем более устойчива комплексная частица, и наоборот. Знание констант устойчивости комплексов позволяет рассчитывать равновесные концентрации частиц в растворах, проводить сравнительную оценку прочности комплексов и т. д.
Устойчивость комплексов зависит от прочности химической связи между комплексообразователем и лигандами и определяется рядом факторов, таких как природа комплексообразователя, лиганда, растворителя.
Использование констант образования комплексов позволяет отличать их от солей. Комплексы и соли по-разному ведут себя в водных растворах: соли диссоциируют необратимо на катионы и онионы, а в комплексах происходит обратимое замещение лигандов на молекулы воды, характеризуемое соответствующими константами. Так, FeCl3 относится к солям
FeCl3 = Fe3+ + 3Cl–,
поскольку для FeCl3 β3 ≈ 6, и в разбавленных водных растворах диссоциация практически необратима.
В то же время [Fe(NCS)3] – комплексное соединение:
[Fe(NCS)3] Fe3+ + 3NCS–; β3 ≈ 105.

 HgBr+
HgBr+






