
- •Правила роботи в лабораторії хімії
- •Теоретичні питання:
- •Завдання для самопідготовки:
- •Скласти електронну та графічну конфігурацію:
- •Що спільного у будові даних атомів?___________________________________________________________
- •Як змінюються окисні властивості серед простих речовин галогенів?
- •Лабораторна робота
- •Звіт про лабораторну роботу
- •Контрольні завдання:
- •Лабораторне заняття № 2 Тема: Виявлення хлорид-йону в розчині.
- •1. Способи добування хлору.
- •Теоретичні питання :
- •Завдання для самопідготовки :
- •2.До розчину, що містить 0,585г натрій хлориду, додали розчин, що містить 3,58г арґентум нітрату, і осад відфільтрували. Що міститься у фільтраті? Яка його маса?
- •3.Як змінюється сила кислот: hf- hCl- hBr- hi? Від чого це залежить?
- •4.Яким найпростішим способом можна очистити йод від натрієвих солей галогеноводневих кислот?
- •5. Скласти рівняння реакцій та виразити їх у йонній формі (повній та скороченій) між:
- •Лабораторна робота
- •Звіт про лабораторну роботу
- •Контрольні завдання:
- •Лабораторна робота
- •Звіт про лабораторну роботу
- •Контрольні завдання:
- •Скласти рівняння реакції, за допомогою яких можна здійснити перетворення:
- •2. За допомогою рівнянь реакцій доведіть окисно-відновну подвійність sº.
- •Яка маса плюмбум(II) сульфіду утвориться при дії надлишку сірководню на плюмбум(II) нітрат масою 60г з масовою часткою солі 10%?(4,33г)
- •3.Який об’єм сірчистого газу було окиснено хлорною водою, якщо після доливання до одержаного розчину надлишку барій хлориду випало 2,33г осаду?(224мл)
- •Лабораторна робота
- •Звіт про лабораторну роботу
- •Контрольні завдання:
- •Теоретичні питання:
- •Завдання для самопідготовки:
- •Здійснити хімічне перетворення:
- •При дії розчину сульфатної кислоти на 1 кг технічного магній карбонату виділилось 224 л вуглекислого газу. Визначити масову частку домішок у зразку магній карбонату.
- •Відповідь:
- •З якими із поданих речовин взаємодіятиме розведена сульфатна кислота:
- •До яких негативних змін у природі призводять викиди в атмосферу сульфур(IV) оксиду? Відповідь проілюструвати рівняннями реакцій.
- •Лабораторна робота
- •Звіт про лабораторну роботу
- •Контрольні завдання:
- •Лабораторне заняття № 6
- •Теоретичні питання:
- •Завдання для самопідготовки:
- •1. Здійснити хімічні перетворення:
- •Лабораторна робота
- •Звіт про лабораторну роботу
- •Добудьте цинк сульфат двома способами:
- •Лабораторна робота
- •Звіт про лабораторну роботу
- •Контрольні завдання:
- •Скласти електронні формули атомів Нітрогену і Оксигену. Що спільного і що відмінного у їх будові?
- •2. Назвати сполуки:
- •3. Здійснити хімічні перетворення :
- •Лабораторна робота
- •Звіт про лабораторну роботу
- •Контрольні завдання:
- •Лабораторна робота
- •Звіт про лабораторну роботу
- •Контрольні завдання:
- •Скласти рівняння реакцій та виразити їх у йонній формі (повній та скороченій) між:
- •Яку масу кальцій гідроксиду можна нейтралізувати розчином нітратної кислоти масою 50 г , у якому масова частка розчиненої речовини 12,6%?
- •Скласти окисно-відновні рівняння ( методом електронного балансу ):
- •Напишіть рівняння реакцій таких перетворень:
- •Що таке “Царська вода” ? Як діє “Царська вода” на благородні метали ? Скласти рівняння хімічної реакції.
- •Лабораторна робота
- •Звіт про лабораторну роботу
- •Контрольні завдання:
- •Лабораторна робота
- •Звіт про лабораторну роботу
- •Контрольні завдання:
- •Завдання для самопідготовки:
- •6. Написати рівняння реакцій, за допомогою яких можна здійснити такі перетворення:
- •7. У результаті дії на кальцій фосфід утворюється летка сполука фосфору. Напишіть рівняння реакції:
- •Лабораторна робота
- •Звіт про лабораторну роботу
- •Контрольні завдання:
- •Лабораторна робота
- •Звіт про лабораторну роботу
- •Контрольні завдання:
- •Під час нагрівання цинк оксиду з вугіллям утворюється газ, що займається на повітрі, якщо його підпалити. Напишіть відповідні рівняння.
- •Де знаходиться у природі і у яких галузях використовується вуглекислий газ?
- •При доокисненні карбон (іі) оксиду киснем одержали 6,72 л вуглекислого газу. Визначити об’єм кисню, який витратився на цей процес, якщо вихід продукту становив 85% від теоретично можливого.
- •Лабораторна робота
- •Звіт про лабораторну роботу
- •Контрольні завдання:
- •Якщо вуглекислий газ пропустити крізь воду, забарвлену лакмусом у фіолетовий колір, то забарвлення стає червоним, а під час нагрівання знову змінюється на фіолетове. Поясніть ці явища.
- •Здійснити перетворення:
- •3. Скласти рівняння реакцій та виразити їх у йонній формі (повній та скороченій) між:
- •Лабораторна робота
- •Звіт про лабораторну роботу
- •Контрольні завдання:
- •Лабораторна робота
- •Звіт про лабораторну роботу
- •Здійснити перетворення:
- •Закінчити можливі реакції:
- •4. Чи можна зберігати розчин мідного купоросу у відрах: а) оцинкованих;
- •Визначте масу калію, яку необхідно використати для приготування 200 г розчину калій гідроксиду з масовою часткою лугу 10%.
- •Лабораторна робота
- •Звіт про лабораторну роботу
- •Контрольні завдання:
- •Ряд електронегативності елементів:
- •Ряд активності металів:
Лабораторна робота
Тема: Виявлення катіону амонію в розчині.
Мета: виявити йон амонію у розчинах солей, вивчити особливості фізичних властивостей солей амонію.
Звіт про лабораторну роботу
-
Дослід№:
Методика виконання
Спостереження
Хімізм процесу
І. Розчинність у воді солей амонію:
У три пробірки наберіть декілька лопаток солей амонію:
№1 NH4CI;
№2 NH4NO3;
№3 (NH4)2SO4. До кожної додайте 1-2 мл H2O та збовтайте.
II. Виявлення йону амонію у розчинах солей амонію:
У пробірку налийте 1-2 мл р-ну NH4CI, додайте 1-2 мл р-ну NaOH та нагрійте у полум’ї спиртівки. У момент закипання піднесіть до пробірки попередньо змочений у дистильованій воді індикаторний папірець. Повторіть дослід, використовуючи NH4NO3.
Висновки: ______________________________________________________________________________________________________________________
Контрольні завдання:
Амоній карбонат добувають змішуванням трьох газоподібних речовин. Яких саме? Складіть рівняння реакції.
2. Скласти рівняння реакцій та виразити їх у йонній формі (повній та скороченій) між:
1) амоній нітратом і натрій гідроксидом;
2)амоній бромідом і арґентум(I) нітратом.
3. Амоніак масою 85 кг пропустили крізь нітратну кислоту масою 380 кг. Обчислити масу амоній нітрату, що утворився при цьому.
4. У двох пробірках без етикеток містяться розчини барій хлориду і амоній хлориду. За допомогою яких хімічних реакцій можна розпізнати ці речовини? Скласти рівняння відповідних реакцій та виразити їх у йонній формі.
5. Обчислити об’єм аміаку, який слід розчинити у 300 г води, щоб приготувати розчин з масовою часткою аміаку 25%.
6. Здійснити перетворення:
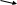
 NH3
← N2
→ NO
NH3
← N2
→ NO
( NH4)2SO4
NO2
NH4)2SO4
NO2

NH4NO3 ← HNO3
ЛАБОРАТОРНЕ ЗАНЯТТЯ № 10
Тема: Властивості нітратної кислоти.
Література:
Ярошенко О. Г. Хімія : Підручн. для 10 кл. загальноосвіт. навч. закл. (рівень стандарту,академічнийрівень). — К. : Грамота, 2010, с. 80-82
Буринська К.М., Величко Л.П.”Хімія”,10клас, Київ, Ірпінь, “Перун” ,1999р. с. 63-67.
План:
Вивчити властивості розведеної і концентрованої нітратної кислоти.
Розв’язання вправ.
Знати:
Властивості нітратної кислоти;
Уміти:
Складати рівняння хімічних реакцій, що характеризують властивості кислоти.
Називати речовини за систематичною номенклатурою.
Теоретичні питання:
Техніка безпеки при роботі з нітратною кислотою.
Добування нітратної кислоти.
Фізичні властивості концентрованої і розведеної нітратної кислоти.
Хімічні властивості нітратної кислоти. Особливості взаємодії кислоти різної концентрації з металами.
Використання нітратної кислоти.
Завдання для самопідготовки:
