
- •Вопрос 1. Предмет физической и коллоидной химии. Роль отечественных и зарубежных ученых в развитии физической химии.
- •Вопрос 2. Предмет химической термодинамики. Основные понятия. Системы изолированные, закрытые, открытые. Состояние системы. Функция состояния. Процессы: изобарные, изохорные и адиабатические.
- •Вопрос 3. Внутренняя энергия системы. Работа и теплота. Нулевое начало термодинамики.
- •Вопрос 4. Первое начало термодинамики и его математическое выражение. Энтальпия. Изохорный и изобарный тепловые эффекты процессов и соотношение между ними.
- •Вопрос 6. Зависимость теплового эффекта процесса от температуры. Уравнение Кирхгоффа.
- •Вопрос 7.Второе начало термодинамики. Обратимые и необратимые процессы. Максимальная работа процессов. Полезная работа.
- •Вопрос 8. Энтропия – функция состояния системы. Изменение энтропии в изолированных системах.
- •Вопрос 9. Изменение энтропии при изотермических процессах и при изменении температуры. Связь энтропии с невероятностью состояния системы. Формула Больцмана.
- •Вопрос 10. Третье начало термодинамики. Абсолютная энтропия. Стандартная энтропия.
- •Вопрос 12. Изменение энергии Гельмгольца и энергии Гиббса в самопроизвольных процессах. Термодинамические условия равновесия. Стандартная энергия Гиббса. Уравнение Гиббса- Гельмгольца.
Вопрос 12. Изменение энергии Гельмгольца и энергии Гиббса в самопроизвольных процессах. Термодинамические условия равновесия. Стандартная энергия Гиббса. Уравнение Гиббса- Гельмгольца.
Под стандартной энергией Гиббса образования понимают изменение энергии Гиббса при реакции образования 1 моль данного соединения из простых веществ. Подобно энтальпии и энтропии:
стандартное изменение энергии Гиббса в ходе химической реакции равно сумме стандартных энергий Гиббса образования продуктов реакции за вычетом суммы стандартных энергий Гиббса образования исходных веществ.
Пользуясь табличными данными можно рассчитать изменение энергии Гиббса в стандартных условиях.
Рассмотрим обратимую реакцию:
N2 (г) +ЗН2 (г) ↔ 2NH3(г) .
Для стандартных условий ∆H° = - 92,4кДж ∆S°= -0,1978 кДж/К
Изменение энергии Гиббса:
∆G0 = ∆H0 - T∆S0 = -92,4 - (0,198 ∙ 298) = 92,4 + 59,0 = -33,4 кДж.
По определению энергии Гельмгольца и Гиббса равны
![]() ,
,
![]() .
(4.78)
.
(4.78)
Однако,
![]() ,
,
![]() ,
,
поэтому соотношения (4.78) можно записать следующим образом:
![]() ,
(4.79)
,
(4.79)
![]() .
(4.80)
.
(4.80)
Выражения (4.79) и (4.80) называются уравнениями Гиббса-Гель-мгольца и имеют практическое значение для изотермических процессов, протекающих с совершением полезной работы без видимого изменения объема.
Для обратимых процессов в закрытых системах, протекающих в изотермических условиях при постоянном давлении или постоянном объеме:
![]() ,
(4.81)
,
(4.81)
![]() .
(4.82)
.
(4.82)
Эти соотношения являются термодинамическими тождествами, и если в них подставить значения
![]() ,
,
![]() ,
,
![]() ,
,
![]() ,
,
то получим очень важные уравнения, связывающие величины полезной работы (суммs немеханических видов работ) с теплотами QP и QV:
 ,
(4.83)
,
(4.83)
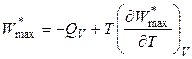 .
(4.84)
.
(4.84)
Уравнения (4.83) и (4.84) также называются уравнениями Гиббса-Гельмгольца или уравнениями максимальной работы. Они позволяют вычислить полезную работу по экспериментальным данным: тепловому эффекту реакции QP или QV и температурному коэффициенту работы.
Следует отметить, что в уравнениях (4.83) и (4.84) теплоты
![]() и
.
и
.
