
- •1.Атом-молекулалық iлiм негiзiнде «Заттар массасының сақталу заңын» түсіндіріп
- •2.Атом-молекулалық iлiм негiзiнде «Құрам тұрақтылық заңың» мәнің ашып беріңіз. Бертолиттер және дальтонидтерге түсінік беріңіз.
- •4.Эквивалент және эквивалент заңың мысалмен түсіндіріп беріңіз.
- •5.Жәй және кұрделi заттардың эквивалентiн анықтау тәсiлдерiн мысалмен тусіндіріңіз.
- •6. Көлемдік қатнастар заңы. Авогадро заңы түралы түсінік беріңіз.
- •7. Газ күйiндегi заттардың массаларын табу тәсiлдерi. Бiр газдың екiншi газ бойынша салыстырмалы тығыздығы.
- •8.Атомның кұрделiлігiн дәлелдейтін жаңалықтарды туралы мәлімет беріңіз.
- •9.Дж. Томсоның моделi мен Резерфордтың атомның ядролық моделiн сипаттап беріңіз.
- •10.Нильс Бор теориясы, онын дамуы және жетiмсiздiгiне сипат беріңіз.
- •11. Атом құрылысы туралы квантты-механикалық көқзарас. Квант сандары.
- •Квант сандары
- •12.Атом қабаттары мен қатпарларын толтырудағы ерекшеліктері туралы түсінік беріңіз (Клечковский және Хунд ережелерi).
- •13.Атом қабаттары мен қатпарларын толтырудағы ерекшеліктері туралы түсінік беріңіз (Паули және минимал энергия принципi.).
- •14.Химиялық элементтердiң қасиеттерiнiң периодтылығын мысал негізінде тусіндіріңіз (иондану энергиясы, электронға ынтықтық, электртерiстiк).
- •15.Химиялық элементтердiң қасиеттерiнiң периодтылығын мысал негізінде тусіндіріңіз (атом және ион радиусы, элементтердың металдық және бейметалдық қасиеттерi).
- •16.Химиялық байланыс туралы ұғымның дамуы және химиялық байланыстардың түрлеріне сипат беріңіз.
- •17.Химиялық байланыстардың түрлері (коваленттi полюстi және полюссiз, донорлы-акцепторлы (координациялық) және түзiлу механiзмiн мысалмен тусіндіріңіз.
- •4.2 Координациялық теория
- •19.Коваленттi байланыстың қасиеттерiн (байланыс ұзындығы, энергиясы, полюстiгi, еселік байланыстар) мысалмен тусіндіріңіз.
- •20.Коваленттi байланыстың қасиеттерiн (бағытталуы, гибриттенуi, молекулалардың пiшiнi) мысалмен тусіндіріңіз.
- •3.5 Гибридтену
9.Дж. Томсоның моделi мен Резерфордтың атомның ядролық моделiн сипаттап беріңіз.
Томсон моделі. 1904 жылы Томсон бірінші болып атом моделін ұсынды. Томсонның айтуы бойынша диаметрі 1 Ангстремге тең шеңбердің ішінде оң заряд бірдей тығыздықпен шашыратылған, ал осы зарядтардың ішінде электрондар бос жүреді.
Резерфорд моделі. 1911 жылы ағылшын ғалымы Резерфорд планетарлық модель ұсынды. Резерфорд моделі бойынша атомның ішіндегі оң зарядты ядроны теріс зарядты электрондар қоршап, айналып жүреді. Оң заряд атомның ортасында шоғырланған. БҒл модельдің дұрыс екені мынадай тәжірибемен дәлелденді. Бір элементтен алынған ( - бөлшектердің жолына жұқа металл фольгасы қойылды, оң зарядты ( - бөлшектердің бір бҰлҢгҢ фольгадан тура өте шықты. Ол жерде теріс зарядты электрондар болғаны, бір бҰлҢгҢ бағытын аз өзгертті, олар оң зарядты ядроны жанай өткендері, ал аз мөлшері қайта тебілді, олар оң зарядты ядродан тебҢлгенҢ. Ядро кішкентай болады. Осы модель Томсон моделінің дұрыс емес екенін көрсетті. Бірақ электрондар саны жөнінде мәлімет бере алмады.
10.Нильс Бор теориясы, онын дамуы және жетiмсiздiгiне сипат беріңіз.
1913 жылы Дания физигі Нильс Бор планетарлық атом моделін негізге алып, атом құрылысының жаңа теориясын ұсынды. Бор теориясының постулаттары (қағидалары).
1. Электрон ядроны айналғанда, кез келген емес, квант теориясынан шығатын кесімді шарттарға сай орбиталар бойымен ғана қозғалады. Ол орбиталар стационар немесе квантталған орбиталар деп аталады.
2. Электрон өзіне тиісті квантталған орбитамен айналғанда, энергия жұмсамайды.
3. Электрон бір орбитадан екінші орбитаға көшкенде ғана энергия бөлінеді немесе сіңіріледі.
Бор теориясы бойынша орбитаның радиусын және электронның жылдамдығын есептеуге болады.
 және
және

 -
Планк тұрақтысы
-
Планк тұрақтысы
 -
3,14;
-
3,14;
 - электрон заряды;
- электрон заряды;
 - электрон массасы.
- электрон массасы.
Егер
барлық тұрақтыларды (
=6,6262.10-34
Дж.с;
- 3,1415;
=9,1095
.10-31
кг;
=1,6022.10-19
Кл) орнына қойсақ:
 =0,053
нм.n2
болып шығады, бұл формулада n квантталған
орбитаның немесе квант қабатының нөмірі.
=0,053
нм.n2
болып шығады, бұл формулада n квантталған
орбитаның немесе квант қабатының нөмірі.
( =2,187 . 106 м/сек . 1/n
Бор теориясы бойынша орбитаның энергиясын есептейді:
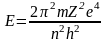
 -
ядро заряды,
тедеуге тұрақтыларды
қойса, келесҢ формула шыады:
-
ядро заряды,
тедеуге тұрақтыларды
қойса, келесҢ формула шыады:
 ,
мҒнда
,
мҒнда
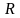 - Ридберг тұрақтысы.
- Ридберг тұрақтысы.
Электрон бір орбитадан екінші орбитаға ауысқанда, энергия былай өзгереді:

Бор теориясы атом құрылысы туралы ғылымды біраз алға жылжытты, Бірақ оның көп кемшіліктері болды. Спектр сызықтарының мультиплеттілігін түсіндіре алмады, көп электронды атомдарға қолдануға болмайды, химиялық байланыстардың сандық мәнін есептеп шығаруға болады.
11. Атом құрылысы туралы квантты-механикалық көқзарас. Квант сандары.
Кванттық механика
Атом құрылысының азіргі замандағы теориясы кванттық механика. Кванттық механика атомдардың, молекулалардың, кристалдардың ішіндегі микробөлшектердің қозғалысын зерттейді. ХҚХ ғасырдың алғашқы жартысында материалды бөлшектің әрі бөлшек, әрі толқын екені дәлелденген. Жарықтың интерференциясы және дифракциясы зерттеліп, олардың электр магниттік толқындар екені дәлелденді және жарықтың фотон деп аталатын бөлшектердің ағыны екені анықталды. Столетов ашқан фотоэффект құбылысы жарықтың және рентген сәулесінің бөлшектік қасиетін дәлелдеді.
