
полезная метода
.pdf
384
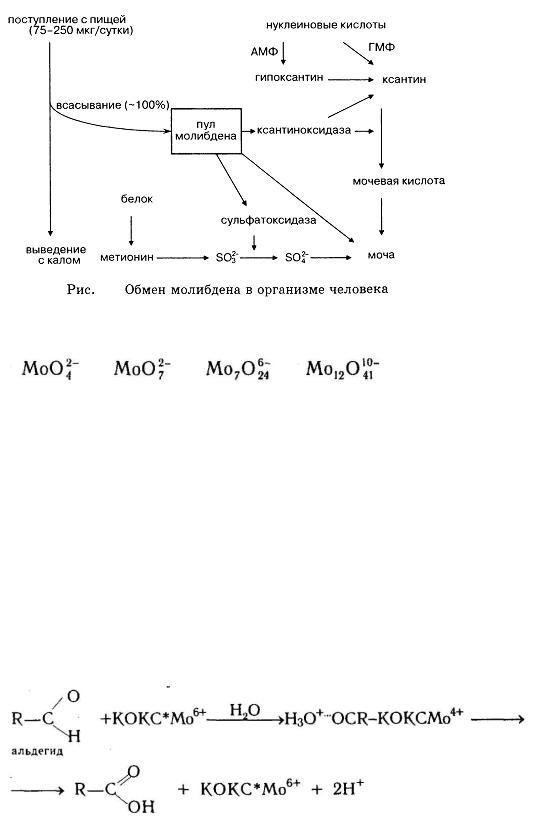
В крови преобладает Mo(VI), если лигандом будет кислород, то образуются устойчивые изополимолибдат-ионы:
Избыточное содержание молибдена в пище нарушает метаболизм Са2+ и РО43– , вызывая снижение прочности костей — остеопорозы. Возможно,
происходит связывание MoO42– и PO43– в фосфорномолибденовые комплексы состава [PMo12O40]3–, [РМо11О39]7–, [P2Mo17O61]I0–. Такие комплексы можно рассматривать как кислотные остатки гетерополимолибденовых кислот. С
кальцием эти остатки дают нерастворимые кристаллики. Не исключено, что эти кристаллики инициируют отложение солей мочевой кислоты и вызывают заболевание подагрой. Подагра деформирует суставы, оправдывая свой буквальный перевод, как «капкан для ног».
Кроме кислородных комплексов, молибден образует галогенидные (Наl–), тиоцианатные (NCS–) и цианидные (CN–) комплексы.
Молибден входит в состав различных ферментов. В организме человека к ним относятся альдегидогидроксидазы, ксантиндегидрогеназы, ксантиноксидазы.
Молекулярная масса ксантиноксидазы (КОКС) 250 000. Это молибденсодержащий фермент млекопитающих. Он может катализировать окисление ксантина и других пуринов, а также альдегидов. В ходе ферментативной реакции молибден (VI) переходит в молибден (V), а потом в молибден(IV).
385

Превращение гипоксантина и ксантина в мочевую кислоту, катализируемое ксантиноксидазой, происходит по схеме:
Предполагается, что в ходе каталитического процесса молибден образует связь с азотом и кислородом ксантина.
Молибден является важнейшим микроэлементом растений, так как биологически активные вещества с его участием обеспечивают мягкую фиксацию азота: превращают в аммиак или азотсодержащие продукты.
По сравнению с другими промышленно важными металлами молибден малотоксичен.
Потребление молибдена с продуктами питания 0,1—0,3 мг/сут, но необходимое дневное поступление не установлено. Дефицит молибдена вызывает уменьшение активности ксантиноксидазы в тканях. Избыточное содержание молибдена вызывает остеопорозы.
§4. Элементы VII Б группы
Марганец Мn, технеций Тс и рений Re — элементы-аналоги, образующие группу VIIB.
Из элементов VIIB-группы только марганец является биогенным элементом и одним из десяти металлов жизни, необходимых для нормального протекания процессов в живых организмах.
386
Калий перманганат KMnO4 — наиболее известное соединение марганца, применяемое в медицине. Используют водные растворы с содержанием КМnО4 от 0,01 до 5%, В качестве кровоостанавливающего средства применяют 5%-ный раствор. Растворы калия перманганата обладают антисептическими свойствами, которые определяются его высокой окислительной способностью.
Перманганат КМnО4 хорошо растворим в воде. Перманганаты — сильные окислители. Это свойство используется в медицинской практике для дезинфекции, в фармакопейном анализе для идентификации Н2О2 путем взаимодействия с КМnО4 в кислой среде (перманганатометрия). Количественное содержание КМnО4 в препаратах Государственная фармакопея рекомендует определять иодометрически путем проведения реакции с KI в кислой среде.
Глубина превращения перманганата зависит от рН среды, в которой протекает реакция. При сравнении стандартных окислительновосстановительных потенциалов видно, что наиболее сильные окислительные свойства перманганат-ион проявляет в кислой среде:
МnО4– + 8Н++5е =Мn2+ + 4Н2О; 0 = 1,52 В МnО4– +2H2O+3e = MnO2 +4OH–; 0 = 1,23В МnО4– + 1е = МnО42– ; 0 =0,56 В
Высокую окислительную способность перманганата используют в экологии для оценки загрязненности сточных вод (перманганатный метод). По количеству окисленного (обесцвеченного) перманганата определяют содержание органических примесей в воде. Перманганатный метод (перманганатометрию) используют также в клинических лабораториях для определения содержания мочевой кислоты в крови.
Вследствие высокой окислительной способности кислородные соединения марганца в высших степенях окисления в организме не существуют.
Для организма перманганаты являются ядами, их обезвреживание
может происходить следующим образом: 2КМnО4+5Н2О2+6Н+ =2Мn2++2К+ +8Н2О+5О2
Для лечения острых отравлений перманганатом используется 3%-ный водный раствор Н2О2, подкисленный уксусной кислотой.
Калий перманганат окисляет органические вещества клеток тканей и микробов. При этом КМnO4 восстанавливается до МnО2 Марганец (IV) оксид может также взаимодействовать с белками, образуя комплекс бурого цвета.
Под действием калия перманганата КМnО4 белки окисляются и свертываются (коагулируют). На этом основано его применение в качестве наружного препарата, обладающего противомикробными и прижигающими свойствами. При этом его действие проявляется только на поверхности кожи и слизистых оболочек. Окислительные свойства водного раствора КМnО4 используют для обезвреживания токсичных органических веществ. В
387
результате окисления образуются менее токсичные продукты. Например, наркотик морфин превращается в биологически малоактивный оксиморфин.
Из других соединений марганца следует отметить марганец (II) сульфат и марганец (II) хлорид, которые используют при лечении малокровия.
Втеле взрослого человека содержится 12 мг (1,6 10–5 %). Марганец концентрируется в костях (43%), остальное — в мягких тканях, в том числе и
вмозге.
Ворганизме марганец образует металлокомплексы с белками, нуклеиновыми кислотами, АТФ, АДФ, отдельными аминокислотами. Содержащие марганец металлоферменты: аргиназа, холинэстераза, фосфоглюкомутаза, пируваткарбоксилаза.
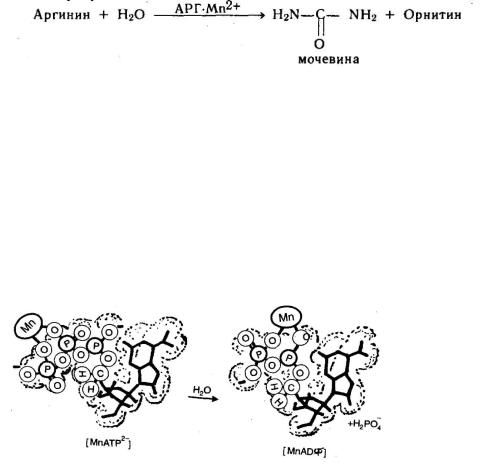
Связывание аммиака — токсичного продукта превращения аминокислот в организме млекопитающих осуществляется через аминокислоту аргинин. Аргиназа — фермент, катализирующий в печени гидролиз аргинина. В результате аргинин расщепляется на мочевину и циклическую аминокислоту орнитин:
Мочевина — нетоксичное, растворимое в воде вещество. Оно потоком крови доставляется в почки и выводится с мочой.
Атомный радиус марганца 128 пм. Это объясняет то обстоятельство, что марганец может замещать магний (атомный радиус 160 пм) в его соединении с АТФ, существенно влияя на перенос энергии в организме.
Гидролиза аденозинтрифосфата (АТФ) до аденозиндифосфата (АДФ) обеспечивает энергетику жизнедеятельности. В организме этот процесс активируется магнием в результате образования комплексов МgАТФ2– и MgAДФ–. Однако установлено, что активацию могут осуществлять и ионы марганца Мn2+. При этом оказывается, что комплексы МnАТФ2– и МnАДФ– более активны. Участие марганца в гидролизе можно представить в виде:
Ионы Mg2+ и марганца Мn2+ осуществляют также активацию ферментов — нуклеаз. Эти ферменты катализируют в двенадцатиперстной кишке гидролиз нуклеиновых кислот ДНК и РНК. В результате эти биополимеры расщепляются на мономерные единицы — нуклеотиды. В частности такой нуклеазой является дезоксирибонуклеаза, которая катализирует гидролиз ДНК только в присутствии ионов Mg2+ или Мn2+.
388
Марганец может входить и в состав неорганических соединений организма. Это, например, малорастворимый марганец магний пирофосфат MnMgP2O7. Кристаллы этой соли локализуются на внутренней поверхности мембраны везикул.
Почти одинаковое значение атомного радиуса марганца (128 пм) и железа (126 пм) объясняет способность марганца замещать железо в порфириновом комплексе эритроцита. По той же причине марганец может замещать и цинк (атомный радиус 127 пм) в цинкзависимых ферментах, изменяя при этом их каталитические свойства.
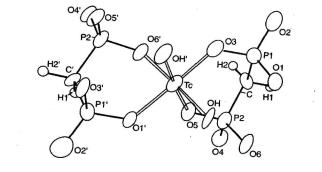
О наличии технеция в живых организмах данных нет. Однако соединения технеция с бисфосфонатами используют для радио-изотопного метода диагностики. Метастабильный изотоп технеция 99Тс является излучителем лучей. В первые минуты после внутривенного введения препарата «Технефор», содержащего 99Тс, можно исследовать состояние мягких тканей, через 2—3 ч после введения — костных. Ниже приводится формула строения комплекса Тс с бисфосфонатом:
В соединении с бисфосфонатом технеций обычно четырехвалентен, при этом координационное число может быть равным 6, что хорошо видно на схеме.
Таким образом, для решения медико-биологических задач используются не только соединения жизненно необходимого Мn, но и соединения искусственного элемента 99Тс.
§5. VIII Б-группы (семейство железа и семейство платины)
В VIIIB-группе периодической системы расположены химические элементы — переходные металлы: Fe, Co, Ni, Rn, Rh, Pd, Os, Ir, Pt.
По распространенности в природе, применению соединений в медицине и технике и роли в организме железо стоит на первом месте в
VIIIB-группе.
Железо Fe и кобальт Со — необходимые микроэлементы живых организмов.
Железо — биогенный элемент, содержится в тканях животных и растений. Общая масса железа в организме взрослого человека примерно 5г, что составляет 0,007%. Металлическое железо мало токсично, а соединения Fe(II), Fe(III) и Fe(VI) в больших количествах опасны для здоровья.
389
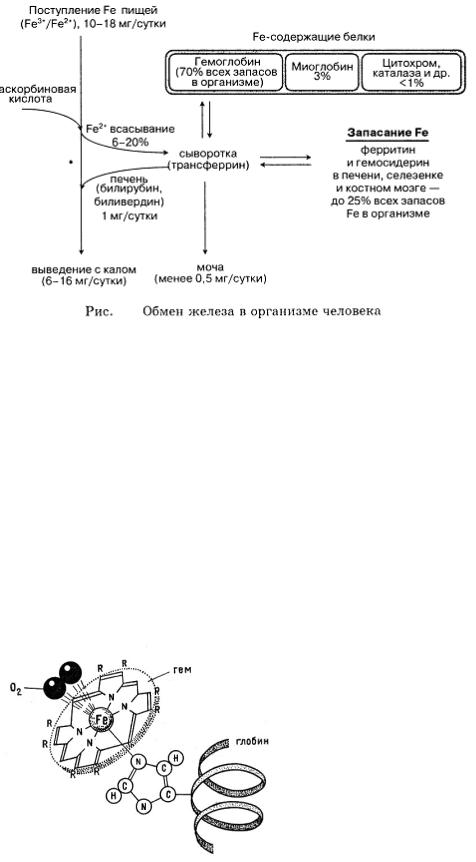
Наиболее важными с физиологической точки зрения являются железосодержащие белки: гемоглобин, миоглобин, цитохромы, пероксидазы, каталаза. Гемоглобин — главная составная часть эритроцитов. Общее содержание гемоглобина равно 700г, а кровь взрослых людей содержит в среднем около 14 – 15%. Обеспечивает внешнее дыхание, являясь переносчиком кислорода от легких к тканям. Миоглобин, цитохромы, каталаза обеспечивают клеточное дыхание. Например, в скелетной и сердечной мышце находится миоглобин. Он способен связывать до 14% общего количества кислорода в организме. Это его свойство играет важную роль в снабжение кислородом работающих мышц. Если при сокращение мышцы кровеносные капилляры её сжимаются и кровоток в некоторых участках мышцы прекращается, в течение некоторого времени сохраняется снабжение мышечных волокон кислородом.
Все эти белки состоят из собственно белковых частей и связанных с ними активных центров:
Активный центр представляет собой макроциклическое комплексное соединение — гем (от греч. — кровь). В качестве макроциклического лиганда выступает тетрадентантное соединение — порфирин. Донорные атомы азота расположены по углам квадрата, в центре которого расположен ион железа. В целом, комплекс имеет октаэдрическую конфигурацию. Пятая
390
