

Коллоидная химия
Лекция № 6.
Получение и очистка дисперсных систем. Молекулярно-кинетические свойства
План:
1.Классификация способов получения дисперсных систем.
2.Диспергирование.
3.Конденсация.
4.Методы очистки. Мембраны и мембранные процессы.
5.Причины молекулярно-кинетических свойств. 6.Броуновское движение.
7.Диффузия.
8.Осмос.
9.Седиментация. 2
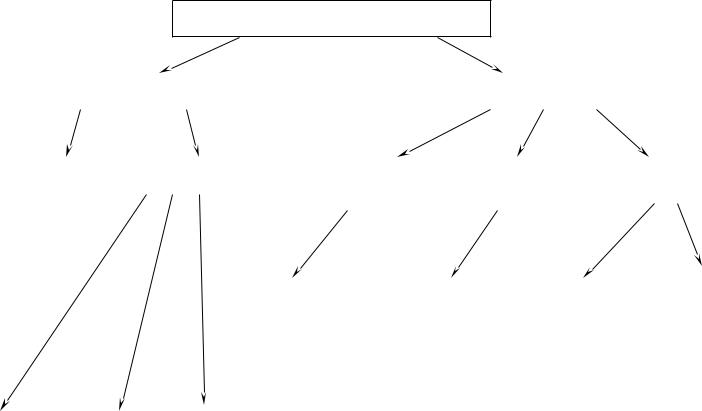
Классификация способов получения дисперсных систем
Способы искусственного получения делятся на две группы
Получение дисперсных систем
Диспергирование |
|
Конденсация |
|
|
|
Самопроизвольное |
|
Несамопроизвольное |
|
|
Кристаллизация |
|
Десублимация |
|
|
Конденсация |
|
||||||||
ж/ж,ж/г, г/ж,г/г) |
|
|
|
|
|
|
(т/ж,т/г) |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Замена |
|
|
|
|
Изотермическая |
|
|
Физическая |
|
|
Химическая |
|
|||||||||
|
|
|
|
|
|
|
|
|
растворителя |
||||||||||
|
|
|
перегонка |
|
|
|
(т/г,ж/г, |
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
(ж/ж,т/ж) |
||||||
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
т/ж,ж/ж) |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Барботаж |
Измельчене |
|
Распыление |
||
(т/г,т/ж) |
|
(ж/г,ж/ж) |
|
(г/ж) |
|
|
|
|
|
3

Диспергирование
Диспергирование характеризуется степенью диспергирования (α). Она определяется отношением размеров исходного продукта и частиц дисперсной фазы полученной системы.
dн,dк - диаметр частиц до и после измельчения.
Работа , необходимая для диспергирования твердого тела или жидкости, затрачивается на деформирование тела д и на образование новой поверхности раздела фаз, которая измеряется работой адгезии.
Деформирование является необходимой предпосылкой разрушения тела. Работа диспергирования определяется формулой:
- величина, пропорциональная или равная поверхностному натяжению на границе раздела, -S - увеличение поверхности раздела фаз в результате диспергирования,
-объем исходного тела до диспергирования,
-коэффициент, эквивалентный работе деформирования единицы объема тела.
Снижение энергии диспергирования может быть достигнуто следующими методами: проведение процесса в жидкой среде, помол с одновременной вибрацией, применение ультразвукового метода.
4
Конденсация
В основе конденсационных методов лежит процесс образования частиц дисперсной фазы из вещества, находящегося в молекулярном или ионном состоянии. Необходимым требованием всех методов конденсации является создание пересыщенного раствора, из которого должна быть получена коллоидная система. Этого можно достичь при определенных физических и химических условиях.
Необходимое условие конденсации и кристаллизации - пересыщение и неравномерное распределение вещества в дисперсионной среде и образование центров конденсации (зародышей).
Физические методы конденсации:
а. сгущение паров жидкостей и твердых тел при охлаждении в результате адиабатического расширения или смешивания продуктов испарений с большим объемом воздуха, б. конденсация из раствора путем постепенного
удаления (выпаривания растворителя или замены другим растворителем, в котором вещество дисперсной фазы нерастворимо.
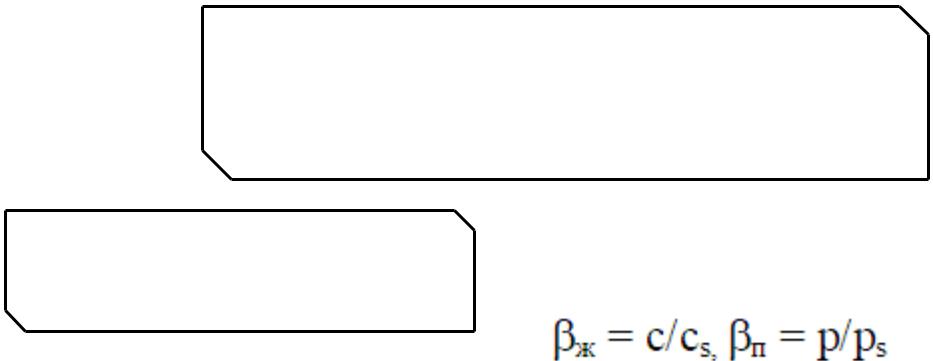
Степень пересыщения для раствора и пара можно выразить следующим образом:
р, с - давление пересыщенного пара и концентрация вещества в пересыщенном растворе, р-равновесное давление насыщенного
пара над плоской поверхностью, с - равновесная растворимость, соответствующая образованию новой фазы.
5
Конденсация
Химические методы конденсации
2HAuCl4 + 3H2O2 = 2Au + 8HCl + 3O2.
В качестве восстановителей металлов можно применять различные вещества: сахар, непредельные углеводороды, танин и другие. Хорошим восстановителем золотой кислоты является танин:
2HAuO2 + C76H52O46 = 2Au + Н2О + С76Н52О49 (флобафен).
Частицы золота заряжены отрицательно, они адсорбируют анионы золотой кислоты AuО2-, в
результате образуются мицеллы: mAunAuO2-(n-x)K+xK+
Устойчивый золь можно получить также путем реакции двойного обмена:
AgNO3 + KI = AgI + KNO3.
Взяв избыточное количество раствора одной из этих солей, можно получить устойчивый коллоидный раствор с частицами определенного знака заряда.
Положительно заряженный золь можно получить, используя реакции гидролиза солей, образованных слабым основанием тяжелого металла и сильной кислотой. Наилучшие условия гидролиза – невысокая концентрация соли и нагревание.
Например, получение гидрозоля железа (III). FeCl3 + 3H2O = Fe(OH)3 + 3HCl
FeCl3 + 2H2O = Fe(OH)2Cl + 2HCl = FeOCl + 2HCl + H2O
FeOCl = FeO+ + Cl-.
Строение мицеллы:
mFe(OH)3nFeO+(n – x)Cl-xCl-
6
Методы очистки. Мембраны и мембранные процессы
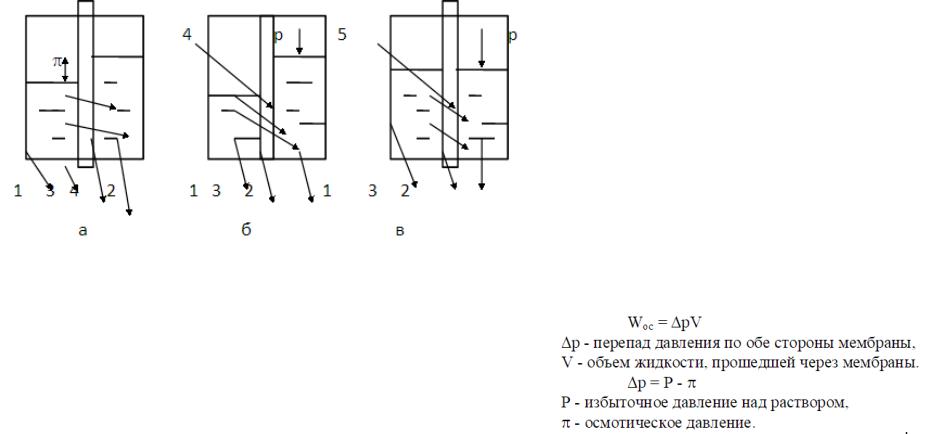
Мембраны - полупроницаемые перегородки, при помощи которых осуществляется осмос. Осмос - самопроизвольный процесс переноса растворителя (дисперсионной среды) через мембрану из растворителя (менее концентрированного или коллоидного раствора) в раствор ( или в более концентрированный раствор).
|
Если со стороны дисперсной системы 2 |
|
приложить давление Р, то поток жидкости из |
|
области 2 будет перемещаться в область 1.Через |
|
мембрану 3 проходят только молекулы |
|
растворителя (вследствие их большей |
|
подвижности). Содержимое области 1 будет |
|
обогащаться чистой жидкостью, а в области 2 |
|
сконцентрируются примеси. |
|
Направление движения жидкости при обратном |
|
осмосе противоположно ее движению в случае |
|
осмоса. |
Схема осмоса (а), обратного осмоса (б), ультрафильтрации и диализа (в) |
Работа, необходимая для осуществления |
1.дисперсионная среда (чистая жидкость)Ж, 2.коллоидный Т/Ж или истинный обратного осмоса, расходуется на продавливание
раствор, 3.мембрана, 4.поток чистой жидкости (растворителя, 5.поток примесей. |
жидкости через поры: |
При помощи диализа осуществляется очистка дисперсной системы от |
|
примесей в виде ионов или молекул. Дисперсную систему помещают в |
|
правую часть 2 сосуда, отделенную от левой части 1 мембраной |
|
3.Мембрана проницаема для молекул и ионов, но задерживает частицы |
|
дисперсной фазы. Примеси в результате диффузии из области большей |
|
концентрации 2 самопроизвольно будут переходить в область меньшей |
7 |
концентрации 1. |

Методы очистки. Мембраны и мембранные процессы
Кроме очистки растворов мембраны способствуют равновесию электролитов в присутствии частиц или ионов, размеры которых не позволяют им проникать через поры, возникает так называемое мембранное равновесие, которое имеет практическое значение для растворов ВМС, в процессах набухания веществ и в различных физиологических процессах.
Схема мембранного равновесия Доннана.
Мембранное равновесие имеет практическое значение для растворов ВМС, в процессах набухания веществ и в физиологических процессах. Мембранная технология намного эффективней других аналогичных технологий, требует меньших энергетических
8 затрат.
Причина молекулярно-кинетических свойств
Все молекулярно-кинетические свойства дисперсных систем вызваны хаотичным тепловым движением молекул дисперсионной среды, которое складывается из поступательного, вращательного и колебательного движений молекул.
Молекулы обладают различной кинетической энергией. Тем не менее, при данной температуре среднее значение кинетической энергии молекул остается постоянным. Флуктуация значений кинетической энергии молекул дисперсионной среды является причиной молекулярно - кинетических свойств.
Броуновское движение
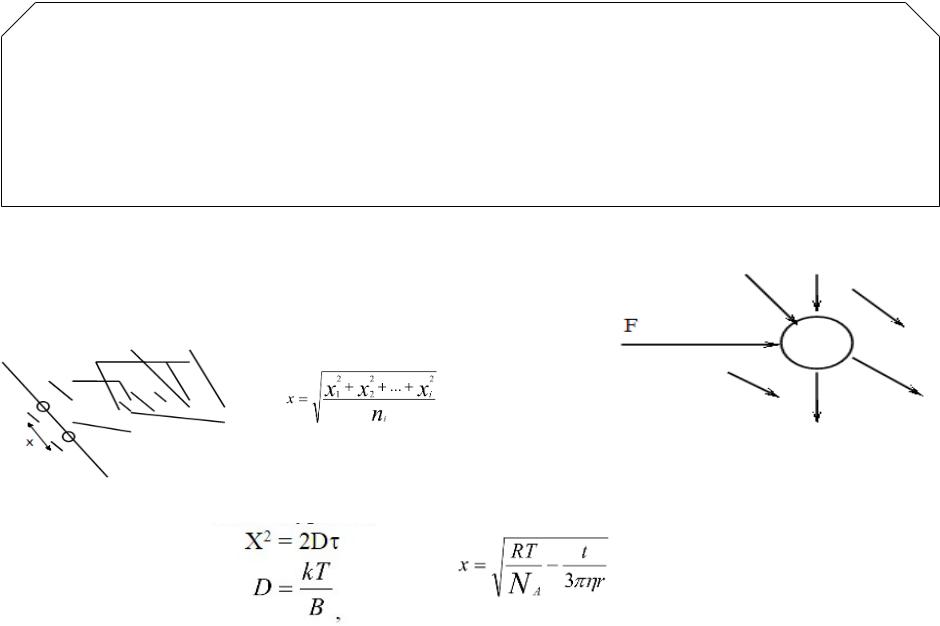
Мельчайшие частицы незначительной массы испытывают неодинаковые удары со стороны молекул дисперсионной среды, на рисунке показана результирующая сила , которая заставляет частицы двигаться.
х1, х2,х - сдвиги частицы за определенное время
Сдвиг частиц |
Броуновское движение частиц описывается уравнением |
|
Эйнштейна –Смолуховского: |
||
|
D = 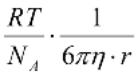
Воздействие молекул дисперсионной среды на частицу дисперсной фазы
t - время, - вязкость дисперсионной среды, - радиус частиц дисперсной фазы
В – коэффициент вязкого сопротивления

Диффузия
Диффузия - процесс самопроизвольного распространения вещества из области с большей концентрацией в область с меньшей концентрацией.
Ионная диффузия связана с самопроизвольным перемещением ионов. Формирование диффузного слоя противоионов на поверхности частиц дисперсной фазы происходит по механизму ионной диффузии.
Скорость перемещения:
основное уравнение диффузии в
дифференциальной форме
Коллоидные частицы характеризуются минимальным коэффициентом диффузии. Количественно диффузия определяетсякоэффициентом диффузии, который связан со средним сдвигом:
Размер частиц дисперсной фазы:
Из этой формулы видно, что коэффициент диффузии зависит и от формы частиц, таким образом, зная коэффициент диффузии, можно определить размер частиц дисперсной фазы. То есть чем больше размер частиц, тем меньше коэффициент диффузии и тем менее интенсивна сама диффузия.
10
