
- •Коллоидная химия
- •План:
- •Понятие о поверхностном слое
- •Поверхностное натяжение (σ)
- •Поверхностное натяжение (σ)
- •Поверхностное натяжение (σ)
- •Когезионные и поверхностные силы
- •Когезионные и поверхностные силы
- •Зависимость энергетических параметров поверхности от температуры
- •Зависимость энергетических параметров поверхности от температуры
- •Зависимость энергетических параметров поверхности от температуры

Коллоидная химия
Лекция № 2.
Основные геометрические и термодинамические параметры поверхностного слоя
План:
1.Термодинамика поверхностных явлений.
2.Поверхностное натяжение.
3.Когезионные и поверхностные силы.
4.Зависимость энергетических параметров от температуры.
2

Понятие о поверхностном слое
Фаза – гомогенная часть системы, однородная по свойствам во всех точках в отсутствие внешних полей.
Некомпенсированные межмолекулярные
силы, локализованные в поверхностном слое, называют поверхностными силами.
В методе Гиббса свойства реальной системы сопоставляются со свойствами идеализированной системы, в которой плотности термодинамических величин сохраняют постоянное значение вплоть до некоторой математической разделяющей поверхности. Разность между значениями термодинамической функции в реальной системе и системе сравнения, отнесенная к площади поверхности, рассматривается как удельное значение избытка соответствующей величины.
Поверхностный слой – это тонкий переходный слой между фазами, в
котором действует поле не скомпенсированных молекулярных сил , затухающее при углублении в каждую из фаз. По толщине этого слоя происходит резкий, но непрерывный переход от свойств одной объемной фазы к свойствам другой.
В методе слоя конечной толщины
поверхность разрыва рассматривается как реальный слой, который отличается от объемных фаз тем, что обладает избыточной энергией σs. В этом методе вводится параметр толщины поверхностного слоя.
3
Поверхностное натяжение (σ)
Работа образования поверхности всегда отрицательна, а приращение поверхностной энергии положительно.
Поверхностное натяжение обусловлено нескомпенсированным полем межмолекулярных сил на межфазной поверхности; σ - фактор интенсивности поверхностной энергии.
Пусть поверхность образуется в обратимых изобарно- изотермических условиях. Тогда изменение поверхности на ds приводит к приращению энергии Гиббса на dG:
dG = σds |
(1) |
|
|
Коэффициент пропорциональности σ называется поверхностным |
|||
натяжением |
|
|
|
|
|
Если совершается только |
|
σ = (dG/ds)P T |
|
|
|
(2) |
|
полезная работа |
|
|
|
|
(образование поверхности) |
Поверхностное натяжение σ – это работа |
|
||
|
δA΄ = – dG = – σds |
||
обратимого процесса образования единицы |
|
||
|
|
||
межфазной поверхности. Для чистых |
|
|
|
индивидуальных жидкостей она численно равна |
|
|
|
удельной свободной поверхностной энергии. |
|
4 |
|
|
|
|
|
Поверхностное натяжение (σ)
Термодинамическое определение поверхностного натяжения вытекает из объединенного уравнение 1-го и 2-го начал термодинамики. Можно записать его для гетерогенной системы относительно изменения энергии Гиббса т.к как условия р, Т =const легко осуществимы экспериментально
dG = – SdT + VdP + σds + Σµidni
S – энтропия, V – объем, µ – химический потенциал, n – количество вещества компонента
В термодинамике коллоидных систем вводится новая переменная – площадь s поверхности раздела фаз. Аналогичным образом это уравнение может быть записано относительно других термодинамических потенциалов (энергии Гельмгольца, энтропии, энтальпии). σ- частная производная от внутренней энергии по площади поверхности раздела фаз, при S, V, n, q - const
|
|
|
|
|
|
|
|
|
|
|
|
|
Объединенное уравнение (1) и (2) начал |
U |
|
H |
|
F |
|
|
G |
|
|
термодинамики может быть записано и |
|||
|
|
|
|
относительно других термодинамических |
|||||||||
|
s,u,n s,p,n |
i |
t, v,n |
i |
v,p,n |
i |
|||||||
|
|
i |
|
|
|
|
|
|
|
потенциалов, при соответствующих |
|||
|
S |
|
|
S |
|
|
S |
|
|
S |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
постоянных параметрах получим: |
σ- определяется энергией, приходящейся на |
|
|
|||||||||||
единицу площади: |
|
|
|
|
|
|
|
|
|
||||
единицы измерения: СИ Дж/м2 = Н м/м 2 = Н/м |
5 |
||||||||||||
СГС Эр1/см2 , Дин/см. |
|
|
|
|
|
|
|
||||||
Поверхностное натяжение (σ)
Физический смысл |
Факторы, влияющие на |
|
поверхностного натяжения |
поверхностное натяжение |
|
|
|
|
1. Работа, расходуемая на разрыв |
Влияние природы фаз: поверхностное |
|
межмолекулярной связи. Чем сильней |
натяжение обусловлено неполным |
|
межмолекулярные связи в данном |
насыщением межмолекулярных связей в |
|
теле, тем больше его поверхностное |
поверхностном слое, оно зависит: |
|
натяжение на границе с газовой |
1. Интенсивности сил межмолекулярного |
|
фазой, т.е. поверхностное натяжение |
||
меньше у неполярных жидкостей со |
взаимодействия в объеме фазы; |
|
слабыми межмолекулярными |
2. Степени «родственности» смежных фаз, |
|
связями. Большим поверхностным |
||
натяжением обладают вещества с |
которая определяет взаимодействие |
|
водородными связями . |
разнородных молекул и снижение |
|
2. Сила, направленная параллельно к |
энергии поверхностного слоя. |
|
Поверхностное натяжение должно быть тем |
||
поверхности. Поверхностные |
||
молекулы, обладая избыточной |
выше, чем больше силы межмолекулярного |
|
энергией, стремятся уйти вглубь |
взаимодействия и чем больше различие в |
|
конденсированной фазы и сжимают |
природе (полярности) граничащих фаз. |
|
поверхность. |
6 |
|
|
||
|
|
Когезионные и поверхностные силы
Связь между поверхностной энергией и энергией сцепления молекул за счет сил Ван-дер-Ваальса в объеме конденсированной фазы дает величина, называемая
работой когезии (Wс).
Это работа, которую необходимо совершить в обратимом изотермическом процессе разрыва на две части столбика данного вещества (фазы) с площадью сечения, равной единице.
Это работа, затрачиваемая на разрыв молекулярных связей в конденсированной фазе при площади сечения, равной единице: Wc = 2σ
Силы Ван-дер-Ваальсова взаимодействия включают три составляющие:
• ориентационный эффект (взаимодействие двух постоянных диполей);
•индукционный эффект – взаимодействие постоянного диполя с неполярной молекулой за счет индуцированного в ней диполя;
•дисперсионный эффект– взаимодействие атомов и молекул за счет мгновенных диполей, которые возникают при движении
электронов вокруг ядер.
Когезионные и поверхностные силы
Энергия когезионных связей и поверхностное натяжение уменьшается в ряду кристаллов:
атомные > ионные > металлические > молекулярные.
У кристаллических тел поверхностное натяжение выше, чем у расплавов, т.к.
энергия связей в кристаллах больше, чем у жидкостей.
Точную информацию о когезии и поверхностном натяжении можно получить из термодинамической характеристики тел, связанных с парообразованием.
В процессе испарения вещества происходит полный разрыв межмолекулярных связей, поэтому работа когезии определяется энтальпией парообразования.
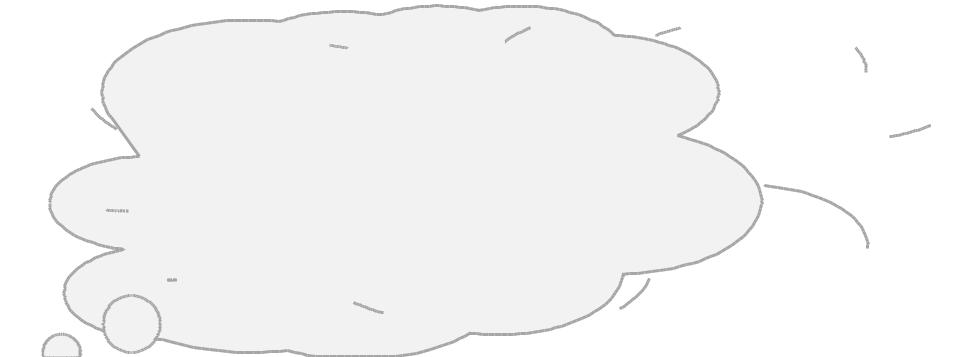
В состоянии равновесии при р,Т = const Gп = 0 и тогда Н = Т Sп
Отсюда следует, что, чем больше энтальпия парообразования (т.е. больше работа когезии, а, значит, и поверхностное натяжение), тем больше его энтропия.
Sn = So - Rln (р/ратм)
So - изменение энтропии парообразования. При температуре кипения: при кипении
р/ратм = 1
L = Ткип So So = L /Ткип
L - энтальпия парообразования при Ткип.
Gп –изменение энергии Гиббса при парообразовании, S – изменение |
|
|
энтропии при парообразовании. Энтальпия парообразования твердых тел |
8 |
|
равна энергии кристаллической решетки. |
||
|
Зависимость энергетических параметров поверхности от температуры
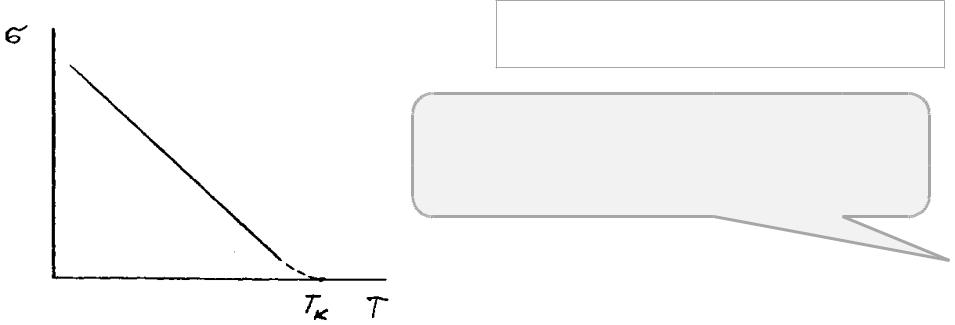
С повышением температуры величина σ
Влияние температуры на жидкостей понижается. поверхностное натяжение
жидкости
Причина снижения поверхностного натяжения с температурой - увеличение среднего расстояния между молекулами и вследствие этого уменьшение сил взаимодействия между ними.
Энергия Гиббса равна сумме энергий |
Для линейного участка кривой σ–Т |
|
σТ = σ0 – α (Т – Т0) |
||
Гиббса G1 и G2 объемных фаз и |
||
поверхностной энергии S |
σ и σ0 – поверхностное натяжение при |
|
G = G1 + G2 + S |
температуре Т и некоторой стан- дартной |
|
G – энергия Гиббса системы; |
температуре Т0 (Т > Т0 > Tпл), α – величина, |
|
равная температурному коэффициенту |
||
G1 и G2 – энергия Гиббса объемных фаз; |
поверхностного натяжения с обратным знаком. |
|
S – поверхностная энергия Гиббса |
||
|
9

Зависимость энергетических параметров поверхности от температуры
По 2 закону термодинамики qs = TSs теплота образования единицы поверхности
(скрытая теплота образования, она равна количеству теплоты, которую нужно сообщить телу, чтобы при постоянной температуре увеличить его поверхность на единицу площади).
Учитывая, что Gs = , можно написать:
Us = + qs
Из уравнения следует, что внутренняя энергия поверхности складывается из энергии Гиббса и теплоты образования поверхности.
Из объединенного уравнения 1 и 2 начал термодинамики, при постоянстве всех параметров, кроме температуры, имеем:
dGs = - S dT или ( Gs/ T)p = -S = -qs/T
– уравнение Гиббса - Гельмгольца, оно связывает поверхностную Us = - T( / T)p энергию с поверхностным натяжением. Для определения полной поверхностной энергии нужно знать зависимость поверхностного напряжения от температуры.
10
