
- •Коллоидная химия
- •Предмет и значение коллоидной химии
- •Предмет и значение коллоидной химии
- •Предмет и значение коллоидной химии
- •Предмет и значение коллоидной химии
- •Предмет и значение коллоидной химии
- •Предмет и значение коллоидной химии
- •Предмет и значение коллоидной химии
- •Предмет и значение коллоидной химии
- •Предмет и значение коллоидной химии
- •Предмет и значение коллоидной химии
- •Предмет и значение коллоидной химии
- •Предмет и значение коллоидной химии

Коллоидная химия
Лекция №1.

Предмет и значение коллоидной химии
Коллоидная химия –раздел физической химии, объектом изучения которого являются дисперсные системы. Коллоидная химия изучает наиболее распространенное (универсальное) дисперсное состояние вещества.
Дисперсные системы – это гетерогенные системы, у которых одна
из фаз сильно раздроблена (диспергирована) и представлена объектами, имеющими очень малые размеры в 1, 2 или 3 измерениях. Необходимо различать дисперсную фазу, которая диспергирована до малых частиц, и дисперсионную среду
– сплошную непрерывную фазу (она может быть жидкой, газообразной или твердой), в которой распределены частицы дисперсной фазы.

Предмет и значение коллоидной химии
На межфазной границе вследствие различий в составе и строении сопряженных фаз межмолекулярные (межатомные) силы всегда не насыщены. Межфазная граница раздела обладает избытком свободной энергии (ее называют свободной поверхностной энергией). Доля поверхностной энергии пренебрежимо мала для макрогетерогенных систем, но весьма значительна для дисперсных систем. В связи с этим коллоидная химия рассматривает дисперсные системы в нерасторжимом единстве с поверхностными явлениями. Физическая основа этого единства – огромная поверхность раздела между фазами.
Коллоидная химия – это учение о свойствах веществ в дисперсном состоянии и поверхностных явлениях в дисперсных системах (или физикохимия дисперсных систем и поверхностных явлений)
(П.А. Ребиндер).
Нерастворимые в воде вещества могут образовывать с водой внешне гомогенные однородные (иногда окрашенные) системы, напоминающие обычные растворы –
«псевдорастворы» или коллоидные растворы:
Коллоидные растворы водонерастворимых полимеров в водной дисперсионной |
3 |
|
среде (реакция 3) называют латексами |
||
|

Предмет и значение коллоидной химии
Свойства коллоидных растворов, отличающие их от истинных (гомогенных систем молекулярной дисперсности):
1. Очень слабо выражены коллигативные свойства (например, очень малые трудно поддающиеся измерению значения осмотического давления).
2.Очень мала скорость диффузии.
3.Проходят через бумажные фильтры, но задерживаются на ультра- фильтрах.
4.Частицы растворенного вещества не видны в оптический микроскоп, но растворы оптически
неоднородны – рассеивают свет (эффект Тиндаля).
5. Растворенное вещество может быть выделено из раствора введением очень малых количеств электролитов, причем этот процесс неспецифичен.
Причина всех этих отличий (особенностей): растворенное вещество на- ходится в системе в виде относительно крупных частиц (агрегатов
молекул или ионов), значительно превышающих молекулярные размеры. Такие растворы не являются истинными (молекулярно- или ионно- дисперсными), это гетерогенные системы, отличающиеся тем, что одна из фаз сильно раздроблена (диспер- гирована). Коллоидные растворы – это типичный пример дисперсных систем. Другие известные из повседневной практики дисперсные системы – эмульсии, суспензии, пасты, пены, дымы, туманы, порошки, пыли и др.
4

Предмет и значение коллоидной химии
Все многообразие дисперсных систем объединяет совокупность двух признаков –
гетерогенность и дисперсность.
Гетерогенность – указывает на наличие межфазной поверхности, на различие в природе (полярности) и структуре фаз. Количественная характери- стика гетерогенности – величина поверхностного натяжения (s). Она определяет степень гетерогенности, резкость перехода от
одной фазы к другой.
Дисперсность (степень раздробленности) определяется размером и геометрией частиц. Дисперсная фаза может иметь малые размеры во всех трех измерениях (частицы), в двух измерениях (волокна, нити, капилляры), в одном измерении (пленки пены, мембраны, адсорбционные слои). Степень раздробленности оценивают:
•величиной D = 1/d (м-1),
•d – поперечный размер частицы. В случае сферических частиц d – диаметр;
•величиной удельной поверхности дисперсной фазы. Удельная поверхность – это суммарная поверхность всех частиц S, отнесенная к их суммарному объему V: Sуд = (S/V) (м-1) или к суммарной массе m: Σ = (S/m)
(м2/кг или м2/г).
Гетерогенность характеризует «качество» поверхности, дисперсность –
ее количество.
Связь между этими характеристиками (для монодисперсного золя со сферическими частицами радиуса r и плотностью ρ):
Sуд = (4πr2)/( 4/3πr3) = 3/r = 6/d = 6D. Σ=3/rρ
5
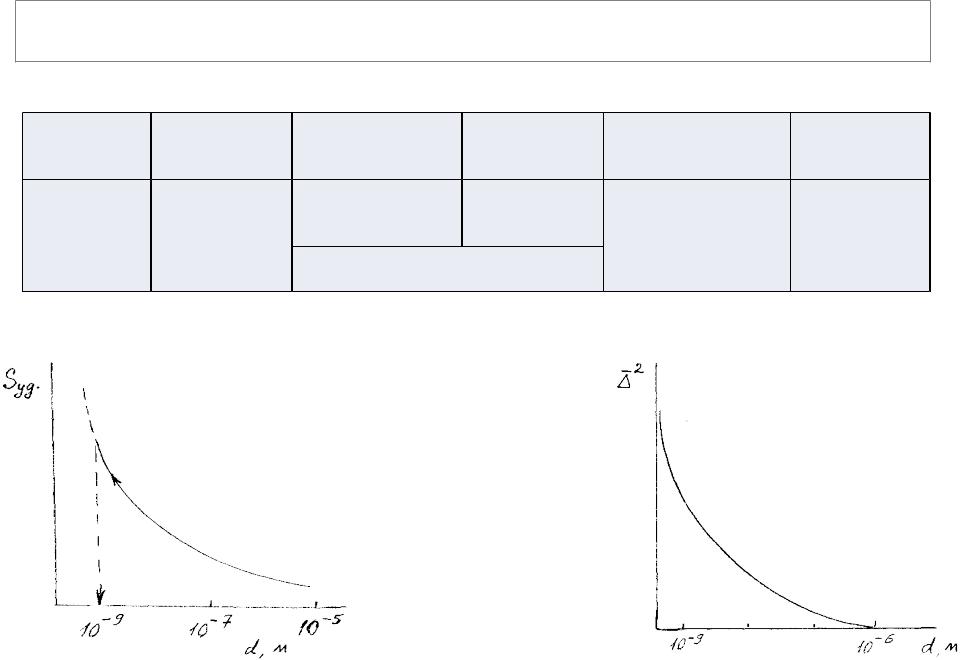
Предмет и значение коллоидной химии
Вряду дисперсных систем особое место занимает область дисперсности, которую называют областью коллоидного состояния вещества, а системы – коллоидными (или золями).
Классификационная диаграмма дисперсности и положение в ней коллоидных
Диаметр |
|
|
систем: |
|
|
|
|
100 нм – |
|
|
|
частиц d, м |
< 1 нм |
1 – 100 нм |
1000 нм |
1 мкм – 0,1 мм |
> 0,1 мм |
|
|
|
(1 мкм) |
|
|
Тип |
Гомогенные |
Ультрамикро- |
Микрогете- |
|
|
системы |
системы |
гетерогенные |
рогенные |
Грубодисперсные |
Макротела |
|
(истинные |
системы |
системы |
системы |
|
|
растворы) |
Коллоидные растворы |
|
|
|
|
|
(золи) |
|
|
|
Рис. 1.1 Зависимость |
Количественные |
Рис. 1.2 Зависимость |
|
удельной поверхности |
границы коллоидного |
||
величины броуновского сдвига |
|||
дисперсной системы от |
состояния (~1…1000 нм) |
||
от размера частиц |
|||
размера частиц |
выбраны не произвольно, |
||
|
|||
|
они обусловлены |
|
|
|
объективными критериями |
|
|
|
– качественными |
|
|
|
скачкообразными |
|
|
|
изменениями свойств |
|
|
|
систем при переходе через |
|
|
|
эти границы. |
|
6

Предмет и значение коллоидной химии
•Нижняя граница коллоидных размеров (~1 нм) обусловлена тем, что при дальнейшем дроблении утрачивается гетерогенность (переход к истинным растворам). При приближении к этой границе удельная поверхность дисперсной фазы достигает предельно больших значений и падает до нуля при переходе через нее (рис. 1.1).
•Верхняя граница коллоидных размеров определяется качественным изменением молекулярно-кинетических свойств – при переходе к грубо- дисперсным системам утрачивается свойственная коллоидным растворам способность к броуновскому движению
Внутри этих границ дисперсные системы имеют признаки и гомогенных, и гетерогенных систем и в то же время отличаются от тех и других.
Коллоидные растворы, как двухфазные системы, отличаются от систем с макрофазами (истинно гетерогенных систем): при малых (коллоидных) размерах термодинамические (и механические) свойства фазы зависят от размера частиц (химический потенциал, давление насыщенного пара, растворимость и т.д. становятся функцией дисперсности). В области коллоидной дисперсности частицы по мере увеличения их размера постепенно приближаются по свойствам к объемной макрофазе.
Таким образом, коллоидные системы образуют качественно своеобразную промежуточную область в ряду дисперсных систем, в которой совершается переход от истинно гомогенных к истинно гетерогенным системам, причем они сочетают в се6е свойства обоих типов систем.
7

Предмет и значение коллоидной химии
Классификация дисперсных систем
1. По агрегатному состоянию фаз – дисперсная фаза (ДФ) и дисперсионная среда (ДС) могут быть в каждом из трех агрегатных состояний – твердом (Т), жидком (Ж) и газообразном (Г), образуя девять различных сочетаний.
Классификация дисперсных систем по агрегатному состоянию фаз
|
Название систем |
Примеры |
Т/Ж |
Лиозоли Суспензии |
Гидрозоли АgI, Au, As2S3, латексы. |
|
Пасты (концентрированные |
Флотационная пульпа, взвеси бактерий, |
|
суспензии) |
вирусов в воде. |
|
|
Тесто пекарное, цементное, керамические |
|
|
массы |
Ж/Ж |
Эмульсии |
Сырая нефть, молоко, маргарин, масло |
Г/Ж |
Пены |
В пищевых производствах, в пожаротушении, |
|
|
латексные пены для производства пенорезины |
Т/Т |
Твердые золи |
Рубиновое стекло и др. цветные стекла, |
|
|
сплавы, резина, горные породы |
Ж/Т |
Твердые золи |
Опал, жемчуг |
Г/Т |
Пористые тела |
Силика- и алюмогели, активный уголь, |
|
|
Пенобетон, пенопласты |
Т/Г |
Аэрозоли |
Дымы, пыли, перистые облака |
Ж/Г |
Аэрозоли |
Дымы, туманы, кучевые облака |
Г/Г |
Системы с флуктуациями |
Атмосфера Земли |
|
плотности |
8 |
|
|

Предмет и значение коллоидной химии
2. По характеру межмолекулярного взаимодействия на границе раздела фаз дисперсные системы делятся на две принципиально различные группы.
•Лиофобные системы
Граничащие фазы сильно различаются по природе, химическому составу, строению. Слабое межмолекулярное взаимодействие дисперсной фазы с дисперсионной средой. Межмолекулярные силы сильно не скомпенсированы на поверхности раздела фаз. Поверхностная энергия велика, s имеет высокое значение (s >> 0). При образовании таких систем энергия диспергирования не компенсируется энергией межмолекулярного взаимодействия на образующейся поверхности (энергией сольватации), и изменение свободной энергии положительно: DG > 0. Такие системы не могут возникать самопроизвольно, они термодинамически неустойчивы, находятся в метастабильном состоянии, требуют специальной стабилизации. При снятии действия стабилизатора частицы при столкновениях слипаются за счет действия сил межмолекулярного притяжения в агрегаты, укрупнение которых приводит к расслоению системы на две макрофазы с минимальной поверхностью раздела и следовательно, с минимальной поверхностной энергией. Такой процесс слипания частиц при их столкновениях называется коагуляцией.
|
|
•Лиофильные системы |
|
|
|
Характеризуются сильным межмолекулярным взаимодействием между дисперсной фазой и |
|
||||
дисперсионной средой и низким значением свободной поверхностной энергии (σ → 0), при |
|
||||
их образовании DG < 0, т.е. они способны образовываться в результате самопроизвольного |
|
||||
диспергирования, |
являются |
термодинамически |
устойчивыми. |
Самопроизвольное |
|
диспергированиие возможно, если энергия диспергирования полностью компенсируется |
|
||||
уменьшением свободной энергии вследствие межфазного взаимодействия на вновь |
|
||||
образующейся поверхности и вследствие возрастания энтропии благодаря включению частиц |
|
||||
в тепловое движение. |
|
|
|
9 |
|
|
|
|
|
|
|
|
|
|
|
|
|

Предмет и значение коллоидной химии
3. По фазовой различимости дисперсные системы бывают:
• Молекулярные коллоиды
– растворы ВМС. Это истинные (молеку- лярные) растворы, гомогенные системы. Однако они обладают многими признаками коллоидного состояния благодаря большому размеру макромо- лекул (малая скорость диффузии, не проходят через ультрафильтры, обла- дают светорассеянием, слабо выражены коллигативные свойства).
• Суспензоиды –
системы, у которых к частицам приложимо термоди- намическое понятие фазы (микрокристаллики, капли жидкости, аморфные образования).
• Ассоциированные коллоиды – частицы представляют собой ассоциа- ты молекул (или ионов), которые находятся в термодинамическом равновесии с молекулярно растворенной частью вещества (мыла, многие красите- ли). Степень ассоциации обычно невелика (десятки или несколько сотен молекул), к таким частицам не может быть в полной мере приложимо тер- модинамическое определение понятия фазы.
10
