
- •Особливості техніки безпеки при роботі з нітросполуками
- •Синтез нітросполук алкілуванням солей нітритної кислоти
- •Лабораторна робота № 1.1
- •Контрольні питання
- •Нітрозування ароматичних сполук
- •Лабораторна робота № 2.1
- •Лабораторна робота № 2.2 синтез 1,2-нафтохінон-1-оксиму нітрозуванням 2-нафтолу
- •Лабораторна робота № 2.3 синтез 4-нітрозодиметиланіліну нітрозуванням диметиланіліну
- •Контрольні питання.
- •Синтез нітросполук
- •Лабораторна робота № 3.1 синтез 4-нітрофенолу окисненням пара-нітрозофенолу
- •Лабораторна робота № 3.2 синтез 2,4-динітрофенолу нітруванням пара-нітрофенолу
- •Лабораторна робота № 3.3 синтез 2,4-динітрофенолу нітруванням пара-нітрозофенолу
- •Лабораторна робота № 3.4
- •Лабораторна робота № 3.5
- •Лабораторна робота № 3.6
- •Контрольні питання.
- •Список рекомендованої літератури
Нітрозування ароматичних сполук
Нітрозування ароматичних сполук відноситься до реакцій С- нітрозування. У такі реакції вступають активовані ароматичні сполуки (третинні ароматичні аміни й феноли). Взаємодія з нітрозо-катіоном протікає по механізму електрофільного заміщення (SE) у одного з атомів Карбону, в орто-пара-положенні відносно яких знаходяться активуючі замісники. У випадку похідних бензену нітрозогруппа майже завжди вступає в пара-положення до ОН- або NR2-групи. Якщо воно занято іншим замісником, то заміщення водню спостерігається орто-положенні. Ця реакція відрізняється дуже високою регіоселективністю. Типовий розподіл орто- і пара-ізомерів при нітрозуванні можна проілюструвати на прикладі самого фенолу.

Для нітрозофенолів характерна таутомерія, таутомерними формами яких є хіноноксими, що відрізняються електронною будовою і кольором:

У розведеному водному розчині сульфатної, фосфатної, хлоратної й інших кислот нітрозуючим агентом є азотистий ангідрид N2O3. Сама нітритна кислота є занадто слабким електрофілом. У сильно кислотному середовищі активною часткою є, імовірно, катіон H2NO2+. Найбільш активний нітрозуючий агент - нітрозилсульфатну кислоту можна отримати тільки в концентрованій сульфатній кислоті при взаємодії з нітритом Натрію.
2 H2SO4 + NaNO2 ? O=N- OSO3H + NaHSO4 + H2O
Активність нітрозуючих агентів зменшується в ряду:
![]()
Слід також зазначити кілька цікавих фактів відносно ароматичних нітрозосполук. Так нітрозосполуки здатні до зворотньої димеризації. Так, нітрозобензен являє собою безбарвну кристалічну сполуку, а його водний розчин має зелений кольор. Причина цього явища полягає в тім, що в кристалічному стані нітрозобензен існує у вигляді димера, а в розчині присутні як димерна, так і мономерна форми.

Взагалі, нітрозогрупа надає органічній речовині синьо-зелене забарвлення (залежно від будови самої молекули).
Положення рівноваги димер-мономер залежить від характеру замісника в ароматичному ядрі - донорні перешкоджають димеризації, у зв'язку із чим пара-нітрозо-N,N-диметиланилін (речовина зеленого кольору) і в розчині і в кристалічному стані існує у вигляді мономера.
Ще одна цікава властивість нітрозогрупи полягає в тому, що при накопиченні цих груп у молекулі речовин вони стають вибухонебезпечними навіть у більшій мірі, ніж це характерно для полінітросполук. Однією з найбільш вибухонебезпечних речовин є гексанітрозобензен, який потужніший за добре відому вибухівку – тринітротолуол.
Лабораторна робота № 2.1
СИНТЕЗ 4-НІТРОЗОФЕНОЛУ НІТРОЗУВАННЯМ ФЕНОЛУ
Рівняння реакції:

Реактиви:
Фенол 5,4 г (0,056 моль);
Нітрит Натрію 5,0 г (0,072 моль);
Сульфатна кислота (d=1,84 г/см3) 2,5 мл.
У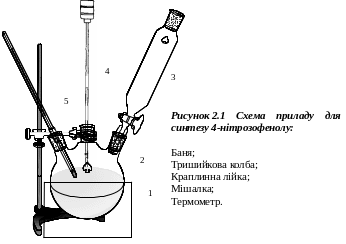 статкування:
статкування:
Примітка: необхідно, щоб мішалка і термометр були занурені в рідину!
В тришийкову колбу об’ємом 200 мл, яка занурена в пусту баню і обладнана мішалкою, краплинною лійкою та термометром, додають 5,4 г фенолу, 60 мл води та 5 г нітриту Натрію. Реакційну суміш розмішують приблизно 5 хвилин, після чого розмішування припиняють. Колбу обкладають подрібненою кригою, яку зверху посипають сіллю. До колби додають 60-70 г подрібненої криги, а в краплинну лійку вливають розчин 2,5 мл сульфатної кислоти в 10 мл води. Вмикають мішалку і протягом однієї години по краплям додають розчин сульфатної кислоти з такою швидкістю, щоб температура маси в колбі не перевищувала 5 оС. Масу розмішують при зазначеній температурі дві години. Коричневий осад, що утворився, відокремлюють від розчину фільтруванням на фільтрі Шотта. Ретельно промивають водою і висушують при кімнатній температурі.
Визначають вихід. Вимірюють температуру плавлення (за літературними даними т. пл. 133 оС) капілярним методом. Відзначають зміни, що відбуваються з речовиною при температурі плавлення або дещо вищій.
Виявляють наявність у пара-нітрозофенолу кислотних властивостей, що свідчить про нітрозування не по Оксигену гідроксилу з утворенням етеру фенілнітриту, а по атому Карбону. Для цього на кінці шпателю в пробірку вміщують пара-нітрозофенол, додають 1 мл води. Потім при струшуванні додають по краплям 5%-й розчин гідрооксиду Натрію до повного розчинення. Розчин, що утворився, підкислюють 20%-ю сульфатною кислотою і спостерігають зміну кольору розчину і утворення осаду вихідної сполуки.
Будову нітрозофенолу підтверджують виконанням якісної реакції, що веде до утворення індофенольних барвників. В пробірку вміщують три-пять крапель концентрованої сульфатної кислоти і крихітку (не більше 1-2 міліграмів) нітрозофенолу. Вміст струшують до розчинення і додають кристалик фенолу. При його розчиненні виникає синьо-фіолетовий розчин.
Утворення хінонімінового барвника відбувається в результаті перебігу реакції:
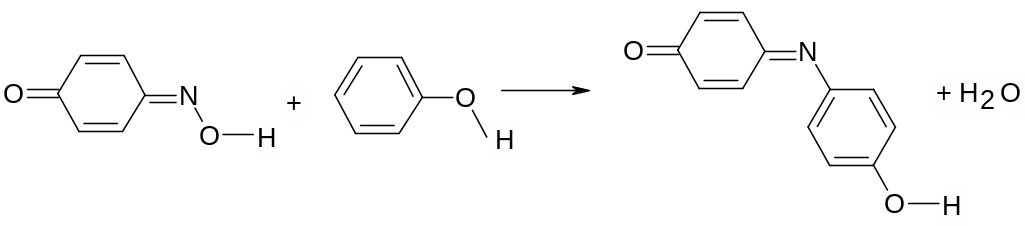
Розчин розбавляють приблизно 3-5 мл води і нейтралізують додаванням 5% розчину гідроксиду Натрію до винекнення слабкого лужного середовища. Відзначають зміни, що мають місце при розбавленні і нейтралізації.
