
- •Особливості техніки безпеки при роботі з нітросполуками
- •Синтез нітросполук алкілуванням солей нітритної кислоти
- •Лабораторна робота № 1.1
- •Контрольні питання
- •Нітрозування ароматичних сполук
- •Лабораторна робота № 2.1
- •Лабораторна робота № 2.2 синтез 1,2-нафтохінон-1-оксиму нітрозуванням 2-нафтолу
- •Лабораторна робота № 2.3 синтез 4-нітрозодиметиланіліну нітрозуванням диметиланіліну
- •Контрольні питання.
- •Синтез нітросполук
- •Лабораторна робота № 3.1 синтез 4-нітрофенолу окисненням пара-нітрозофенолу
- •Лабораторна робота № 3.2 синтез 2,4-динітрофенолу нітруванням пара-нітрофенолу
- •Лабораторна робота № 3.3 синтез 2,4-динітрофенолу нітруванням пара-нітрозофенолу
- •Лабораторна робота № 3.4
- •Лабораторна робота № 3.5
- •Лабораторна робота № 3.6
- •Контрольні питання.
- •Список рекомендованої літератури
мІнІстерство ОСВІТИ І науки УКРАЇНИ ДЕРЖАВНИЙ ВИЩИЙ НАВЧАЛЬНИЙ ЗАКЛАД «ДонецЬкий нацІональнИй технІчНий унІверситет» кафедра фІзичНоЇ І органІчНОЇ хІмІЇ |
|
Методичні вказівки до виконання лабораторних робіт до курсу «Органічні сполуки Нітрогену»
|
|
|
Мисик Д.Д., Бєляєва О.О., Левандовський В.Ю. |
Донецьк, 2014 |
Розглянуто:
на засіданні кафедри
фізичної і органічної хімії
протокол №5 від 09.01.2014
Затверджено:
на засіданні навчальної
і видавничої
ради ДонНТУ
протокол № від
УДК 547.03
Методичні вказівки до виконання лабораторних робіт з курсу «Органічні сполуки Нітрогену». Укладачі: Д.Д. Мисик, О.О. Бєляєва, В.Ю Левандовський. – Донецьк: ДонНТУ, 2014. – 26 с.
Укладачі:
|
Д.Д. Мисик, доц. О.О. Бєляєва, доц. В.Ю Левандовський, ас. |
Рецензент: Л.І. Рубльова, доц.
Відповідальний
за випуск: Ю.Б. Висоцький, проф.
ЗМІСТ
Вступ…………………………………………………………………………………… |
4 |
||
Особливості техніки безпеки при роботі з нітросполуками ………………………. |
5 |
||
1. |
Синтез нітросполук алкілуванням солей нітритної кислоти………………….. |
6 |
|
|
1.1 |
Синтез нітрометану алкілуванням нітриту натрію хлороцтовою кислотою…………………………………………………............................. |
7 |
|
Контрольні питання……………………………………………………………… |
9 |
|
2. |
Нітрозування ароматичних сполук ……………………………………………... |
10 |
|
|
2.1 |
Синтез 4-нітрозофенолу нітрозуванням фенолу……………………….... |
11 |
|
2.2 |
Синтез 1,2-нафтохінон-1-оксиму нітрозуванням 2-нафтолу ..………..... |
13 |
|
2.3 |
Синтез 4-нітрозодиметиланіліну нітрозуванням диметиланіліну……… |
14 |
|
Контрольні питання……………………………………………………………… |
15 |
|
3. |
Синтез нітросполук ………..…………………………………………………..... |
16 |
|
|
3.1 |
Синтез 4-нітрофенолу окисненням пара-нітрозофенолу …………….... |
17 |
|
3.2 |
Синтез 2,4-динітрофенолу нітруванням пара-нітрофенолу……….…… |
19 |
|
3.3 |
Синтез 2,4-динітрофенолу нітруванням пара-нітрозофенолу ..………. |
21 |
|
3.4 |
Синтез пікринової кислоти нітруванням 2,4-динітрофенолу…………… |
22 |
|
3.5 |
Синтез динітротолуєну нітруванням толуєну…………………………… |
23 |
|
3.6 |
Синтез динітронафталену нітруванням нафталену…………………….. |
24 |
|
Контрольні питання……………………………………………………………… |
26 |
|
Список рекомендованої літератури………………………………………………….. |
26 |
||
ВСТУП
Органічна хімія сполук Нітрогену вивчає будову і хімічні властивості таких важливих класів органічних сполук як аліфатичні і ароматичні нітро- і нітрозосполуки, аміни, іміни і багатьох інших. Основною метою цього курсу є вивчення ароматичних моно-, ди- і тринітро-, нітрозосполук та інших, що є енрегонасиченими, або вихідними в синтезі таких сполук.
Мета курсу «Органічні сполуки Нітрогену» - формування на основі сучасних наукових досягнень про закономірності хімічних перетворень органічних сполук Нітрогену в взаємозв’язку з їх будовою; вивчення основних шляхів синтезу ароматичних нітро- і нітросполук; розуміння студентами правил техніки безпеки при синтезі і подальшій роботі з вибухонебезпечними речовинами.
Курс «Органічні сполуки Нітрогену» розроблено для студентів другого курсу групи ТХВ (Хімічна технологія високомолекулярних сполук) денної форми навчання.
Особливості техніки безпеки при роботі з нітросполуками
Всі нітросполуки є більш або менш отруйними речовинами. При наявності в їх молекулах гідроксильної або карбоксильной груп токсичність дещо знижується. Ароматичні нітросполуки сприяють утворенню метгемоглобіну; впливають на центральну нервову систему, викликаючи почуття страху, судороги; чинять токсичний вплив на печінку. Динітросполуки крім отруйної дії на організм викликають подразнення шкіри, дерматити й екземи. Нітросполуки пожежонебезпечні, а полінітросполуки часто відносяться до числа вибухових речовин.
Основним способом захисту при роботі з нітросполуками є точне дотримання правил техніки безпеки. Особливу увагу потрібно звернути на запобігання змішання рідин, у результаті взаємодії яких можуть виділитися шкідливі речовини. Так, наприклад, не дозволяється поєднувати відпрацьовану нітратну кислоту з органічними сполуками. Відомі випадки вибухів при потраплянні нітратної кислоти в спирти, карбонільні сполуки, оцтову кислоту або оцтовий ангідрид. Виділення шкідливих речовин в атмосферу можливо у випадку потрапляння води в нітратну кислоту або суміш, що містить нітратну кислоту. При цьому виділяється велика кількість оксидів Нітрогену. При їх вдиханні може наступити набряк легенів зі смертельним наслідком. З метою запобігання таких випадків треба всі заглибні охолоджувальні елементи в апаратах, що містять нітратну кислоту, виготовляти з кислотостійких матеріалів, а також встановлювати сигналізатори наявності кислоти у воді.
При накопиченні в нітраторі нітратної кислоти, що не прореагувала, можливі удари, викиди й навіть вибухи. У зв'язку з цим необхідно блокувати роботу мішалки з подачею нітросуміші, а також припиняти подачу нітросуміші при підвищенні температури в реакторі вище встановленої.
Безперервне здійснення процесів нітрування, як правило, забезпечує більшу безпеку внаслідок зниження концентрації нітратної кислоти в реакційній масі.
При виконанні лабораторних робіт слід уникати накопичення відходів нітруючих сумішей. Відпрацьовані суміші слід розбавляти виливанням в воду та нейтралізувати лугами або карбонатами лужних металів.
Всі апарати, з яких можливе виділення оксидів Нітрогену, повинні мати поглинальні пристрої та вентиляцію.
Смолисті залишки від перегонки нітросполук здатні самозайматися. Тому їх переробляти без накопичення.
Синтез нітросполук алкілуванням солей нітритної кислоти
Історично першим зручним лабораторним синтезом мононітроалканів була реакція В. Майєра (1876 рік), що полягає у взаємодії алкилгалогенідів із солями нітритної кислоти (AgNO2, NaNO2). При цьому спостерігається перебіг двох конкуруючих реакції: разом із утворенням мононітроалканів спостерігається утворення деякої кількості алкілнітритів _ складних естерів нітритної кислоти. Переважне проходження реакцій залежить головним чином від природи галогеноалкана й металу солі.

За напрямком (1) утвориться естер нітритної кислоти, по напрямку (2) - нітроалкан, у якому атом Нітрогену зв'язаний безпосередньо з атомом Карбону. За допомогою цього методу високий вихід можна одержати тільки при використанні первинних алкилгалогенідів. У сучасному варіанті цього методу застосовують нітрит Натрію й розчинники з гарною здатністю до сольватації – диметилформамід і диметилсульфоксид, які легко розчиняють й алкилгалогеніди і нітрит. У такому випадку галогенування йде з досить високим виходом у випадку первинних і вторинних галогенпохідних за SN2 механізмом. Третинні галогенпохідні реагують тільки за SN1 механізмом й вихід нітропродуктів низький.
В методі Г. Кольбе для синтезу галогеналканів використовують α-галогенкарбонові кислоти, як це показано на прикладі виготовлення нітрометану з хлороцтової кислоти:
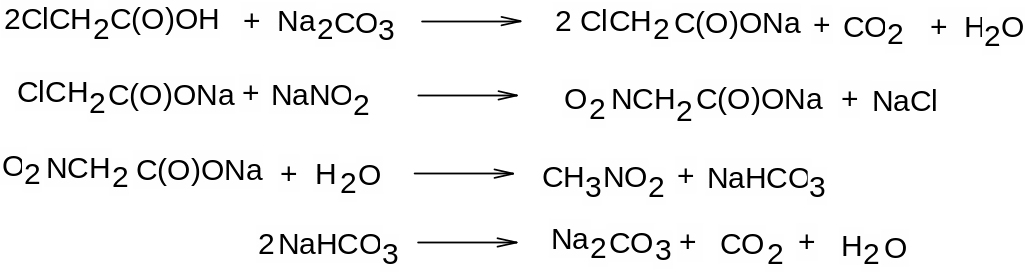
Спочатку одержують сіль хлороцтової кислоти, потім до отриманої солі додають теоретично розраховану кількість нітриту Натрію. При нагріванні утвориться нітрометан. Вихід нітрометана становить 50% від теоретичного (за хлороцтовою кислотою). Було висловлене припущення, що причиною невисокого виходу є розкладання нітрометану бікарбонатом, що утворюється на третій стадії. Тому гідроксид Натрію замінювали на гашене вапно або свіжоосаджений карбонат Кальцію, для того щоб одержати за реакцією замість розчинного у воді бікарбонату Натрію нерозчинний карбонат Кальцію. Однак виявилося, що вихід від цього не підвищився; але все ж таки цей спосіб є більш вигідним для виробництва (крейда дешевше гідроксиду Натрію).
