
- •5. Кинетика изучает скорость химической реакции, ее зависимость от различных факторов и механизмы реакций.
- •2) По агрегатному состоянию:
- •Уравнение изобары:
- •17. Основные положения протолитической теории кислот и оснований Бренстеда-Лоури. Теория Льюиса.
- •20. Гетерогенная система— система, состоящая из нескольких фаз.
- •23. Физическая адсорбция и хемосорбция (проверить!)
- •Правило выравнивания полярностей
- •Значение адсорбции
- •При взаимодействии частиц наблюдается взаимная координация частиц, которую можно определить как процесс комплексообразования
- •По знаку заряда комплекса различают:
- •Качественные реакции с Cr:
- •43.Проверить Кислотно-основное титрование — титриметрические методы определения концентрации кислот или оснований, основанные на реакции нейтрализации:
1.Термодинамическая система – любой объект живой природы, состоящий из большого числа молекул и отделенный от другого объекта природы реальной или воображаемой граничной поверхностью (границей раздела).
Экстенсивные параметры – внутренняя энергия, энтропия, объем – ее значение для системы, сложенной из нескольких частей, равно сумме значений этой величиный всех частей.
Интенсивные параметры – температура, давление – ее значение не зависит от размера системы.
Функция состояния – функция независимых параметров, определяющих равновесное состояние термодинамической системы; не зависит от характера процесса, следуя которому система пришла в рассматриваемое состояние.
К функциям системы относят: внутреннюю энергию, энтропию, энтальпию.
Термодинамическая работа и количество теплоты не являются функциями состояния, т.к. их значение определяется видом процесса, в результате которого система изменила свое состояние. Внутренняя энергия – сумма кинетической энергии всех движущихся молекул данного тела, и потенциальной энергией их взаимодействия (в изохорном процессе.)
Формы перехода энергии от одной системы к другой делятся на 2 группы. В первую входит только одна группа перехода – путем теплопроводности. Мера – теплота – форма передачи энергии путем неупорядоченного движения частиц. Во вторую группу входит перемещение масс, охватывающие большие числа молекул, по действием каких-либо тел. Мера – работа – форма передачи энергии путем упорядоченного движения частиц.
Изолированная система – система, которая не обменивается со средой ни веществом не энергией.
Закрытая система – система, которая не обменивается со средой веществом, но может обмениваться энергией.
Открытая система – система, которая обменивается со средой и веществом и энергией.
Изохорный процесс (V=const)- A=0, т.к не происходит изменение объема.
Изотермический процесс (T=const) –внутренняя энергия системы не меняется.
Изобарный процесс (P=const).
Стандартное состояние – состояние системы, выбираемой как состояние отсчета при оценке термодинамических величин. Необходимость выбора обусловлена тем, что не могут быть рассчитаны абсолютные значения энергии Гиббса, химических потенциалов, энтальпий.
2. Первый закон термодинамики: превращение внутренней Е сис-мы в некотором процессе = теплоте полученное сис-мой + работа, Q = ΔU + A. совершенная над системой.Е не создается и не уничтож. Возможны лишь ее переходы из одного вида в другой в строго эквивалентных кол-вах.
Кол-во е в космосе=const
Внутренняя Е: функция состояния, приращение которой= теплоте полученной сис-мой в изохорном процессе. Тепловой эффект: кол-во теплоты, выделяемой или поглощаемой реагирующей сис-мой.
Тепловой эффект=изменению внутренней Е сис-мы при изохорном процессе и изменению энтальпии при изобарном. Энтальпия — это свойство вещества, указывающее количество энергии, которую можно преобразовать в теплоту. ΔН= ΔU +рV
Закон Гесса: теплота хим р-ции, протекающей при р или V=const определяется только природой исходных в-в и продуктов р-ции и не зависит от числа и последовательности промежуточных стадий при условии, что теплоты измерены при одинаковых t. Следствия: 1) энтальпия образов соединения из простых веществ равна энтальпии его разложения на эти же простые вещества только с обратным знаком 2)энтальпия образования=разности сумм энтальпий образования продукта р-ции и исходных в-в 3)энтальпия сгорания=разности сумм энтальпий сгорания исходных в-в и продуктов р-ции.
Стандартной энтальпией (теплотой) образования вещества при заданной температуре называют энтальпию реакции образования одного моля этого вещества из элементов, находящихся в наиболее устойчивом стандартном состоянии.
Стандартная энтальпия сгорания — ΔHгоро, тепловой эффект реакции сгорания одного моля вещества в кислороде до образования оксидов в высшей степени окисления.
Стандартная энтальпия реакции ΔH ° – тепловой эффект реакции определенного числа молей реагентов, задаваемого уравнением реакции при стандартных условиях.
Живые организмы находятся в постоянной и неразрывной связи с окружающей средой. Эта связь осуществляется в процессе обмена веществ. В биологических системах термодинамически невыгодные (эндергонические) реакции могут протекать лишь за счёт энергии экзергонических реакций. эндергоническая:(1) Глюкоза + Н3РО4 → Глюкозо-6-фосфат + Н2О (ΔG = +13,8 кДж/моль).
В настоящее время закон Гесса рассматривается как следствие 1-го начала термодинамики: приращение энтальпий при образовании заданных продуктов из данных реагентов при постоянном давлении не зависит от числа и вида реакций, в результате которых образовались эти продукты.
3. Второе начало термодинамики. 2 закон термодинамики: невозможен самопроизвольный переход от тела менее нагретого к более нагретому. Невозможно превратить теплоту в работу не приводя никакого другого действия, кроме охлаждения источника тепла.Вечный двигатель 2-го рда невозможен т. е. Такой двигатель, результатом которого было бы получение работы за счет тепла окружающей среды. Все самопроизвольные процессы в макроскопических сис-мах протекают в направлении от менее вероятного к более вероятному состоянию сис-мы.
Необратимые процессы могут протекать самопроизвольно только в одном направлении; таковы диффузия, теплопроводность, вязкое течение и другое.
Процесс называют обратимым, если он допускает возвращение рассматриваемой системы из конечного состояния в исходное через ту же последовательность промежуточных состояний, что и в прямом процессе, но проходимую в обратном порядке.
Энтропия: мера вероятности данного состояния в-ва или системы. Характеризует меру беспорядка в расположении и поведении частиц составляющих сис-му, а также меру стремления частиц занять как можно больший V. Чем больше беспорядка, тем выше энтропия. При достижении равновесия S изолированной сис-мы максимальна.Энергия Гиббса: часть внутренней Е сис-мы которая может быть использована для работы.
В самопроизвольной реакции: G2-G1<0 ;S2-S1>0
Стандартная эн Гиббса ΔG = ΔH – T ΔS (G, кДж):
Процесс называется самопроизвольным, если он осу–ществляется без каких-либо воздействий, когда система предоставлена самой себе.
Существуют процессы, при которых внутренняя энер–гия системы не меняется (ΔЕ = 0). К таким процессам относится, например, ионизация уксусной кислоты в воде.
Целый ряд самопроизвольных процессов протекает с увеличением внутренней энергии (ΔЕ > 0). Сюд относятся, в частности, типичные реакции образования био–неорганических соединений альбумина (белок плазмы крови) с ионами металлов, например Сu2+.Изменение внутренней энергии АЕ для закрытых сис–тем не может служить критерием самопроизвольного про–текания процессов. Изолированная сис-ма: не обменивается со средой ни в-вом, ни Е.Закрытая сис-ма: не обменивается в-вом, но может обмениваться Е.
Энтальпийный и энтропийный факторы. Выражение для свободной энергии Гиббса можно написать и в другом виде: ΔG = ΔН – ТΔS.1) Пусть ΔН < 0 (экзотермический процесс), а ТΔS > 0.Тогда из формулы ΔG=ΔН – ТΔS видно, что ΔG < 0 и процесс протекает самопроизвольно.2). ΔН> 0 (эндотермический процесс), ТΔS < 0 и тогда ΔG > 0. В этом случае самопроизвольный процесс не протекает, но может протекать при затрате энергии из окружающей среды.3) ΔН = ТΔS и тогда ΔG = 0. Наступает термодинамическое равновесие в системе.4) ΔН < 0 и ТΔS < 0, ΔН > 0 и ТΔS > 0. В этом случае значение ΔG зависит от того,какая из величин больше: ΔН или ТΔS.Если ТΔS >> ΔН, то ΔG < 0; если ТΔS << ΔН, то ΔG < 0.
4. Стандартной энергией Гиббса образования вещества называют стандартную энергию Гиббса реакции образования 1 моль данного соединения из простых веществ, находящихся в термодинамически устойчивых модификациях, которая проведена в стандартных термодинамических условиях.
Энергия Гиббса реакции =алгебраической сумме энергий Гиббса образования стехиометрического количества продуктов за вычетом алгебраической суммы энергий Гиббса образования стехиометрического количества реагентов.
Направление химической реакции определяется дельтаG.Если эта величина отрицательна, то реакция протекает самопроизвольно и сопровождается уменьшением свободной энергии. Такие реакции называются экзергоническими. Если при этом значение дельтаG велико, то реакция идет практически до конца и ее можно рассматривать как необратимую. Если дельтаG положительна, то реакция будет протекать только при поступлениеи свободной энергии извне. Такие реакции называются эндергоническими. В биологической системе термодинамически невыгодные реакции могут протекать только за счет энергии экзергонических реакций – энергетическое сопряжение. Многие из них происходят при участии АТФ, играющую роль сопрягающего фактора. Реакция фосфолирования глюкозы свободным фосфатом с образованием глюкозо-6-фосфата является эндергонической
Глюкоза +H3PO4-----глюкозо-6-фосфат + H2O.
Для протекания такой реакции в сторону образования глюкозо-6-фосфата необходимо ее сопряжение с другой реакцией, величина которой больше, чем требуется для фосфолирования глюкозы.
АТФ---АДФ+H3PO4.
Принцип энергетического сопряжения: Принцип в том, что протекание одних процессов сопрягается с протеканием других, за счет этого ЭКОНОМИТСЯ энергия. Пример сопряжения - окислительное фосфорилирование - при прохождении протонов по электрохимическому градиенту через канал в мембране митохондрии выделяется энергия, которая тут же идет на образование АТФ из АДФ и Фн.
5. Кинетика изучает скорость химической реакции, ее зависимость от различных факторов и механизмы реакций.
Основные понятия: Ограниченность термодинамического подхода(в термодинамике не определяется быстрота) -Гомогенность и гетерогенность реакции
-Определяется по агрегатному состоянию реагентов в (одной фазе и в разных фазах)
Скорость реакции- изменение концентрации вещества в единицу времени. Ʊ=∆с/∆t. Истинная скорость- положительна . Ʊист=dс/dt Химическое равновесие-когда скорости прямой и обратной реакций сравниваются. Классификация реакций: 1)по механизму: простые- осуществляется посредством однотипных элементарных актов
-сложные- разнотипные элементарные акты
2) По агрегатному состоянию:
-гомогенные-все исходные вещ-ва в одной фазе, реакция идет по всему объему смеси
-гетерогенные- исх. вещ-ва в разных фазах, важна площадь соприкосновения реагирующих вещ-в.
Молекулярность реакции- число молекул, учавствующих в простой реакции.
Кинетические уравнения:
-Нулевой, V=k
-первого порядка, V=kc (k-константа скорости реакции)
-второго порядка, V=kc2
Порядок реакции- сумма показателей степеней концентраций реагирующих вещ-в. Период полупревращений- промежуток времени, в течении которого начальное кол-во реагента или его концентрация уменьшаются в 2 раза. T1/2=ln2/k.
Последовательные реакции. При последовательных реакциях продуктыодной стадии являются исходными для последующей
![]()
Если одна из стадий протекает значительно медленнее других, то эта стадия будет определять скорость всего процесса и ее называют лимитирующей стадией. По такому механизму идет гидролиз АТФ и крахмала, окисление питательных веществ доСО2 и Н2О в организме.
2.
Параллельные реакции. Реакции, в ходе
которых из одних и тех же исходных
веществ одновременно образуется
несколько продуктов реакции. А + В=д и
= е
 Скорости превращения по каждому из
параллельных путей
Скорости превращения по каждому из
параллельных путей

 соответственно равны.
соответственно равны.
Например, реакция разложения гидразина может идти по двум параллельным путям: N2Н4 → N2 + 2Н2
3N2Н4→4NН3 + N2
3. Сопряженные реакции. С одним и тем же реагентом могут реагировать одновременно два или более веществ и такие реакции называются сопряженными. Например: А + В → АВ; А + Д → АД.
В некоторых случаях одна реакция ускоряет своим течением другую. Одна идет самостоятельно, вторая — только в присутствии первой. Синтез пептидов и белков идет только в присутствии реакции гидролиза АТФ. Многие биохимические реакции в организме протекают по механизму сопряженных химических реакций. 74
5. Цепные реакции протекают с участием свободных радикалов через ряд регулярно повторяющихся элементарных реакций. Каждая реакция состоит из трех стадий: инициирование цепи — образование свободных радикалов под влиянием облучения, теплового воздействия; рост цепи, обрыв цепи, в результате которого образуются нейтральные молекулы.
6. Для реакции
аА + вВ →сС + dD можно записать: V = k[A]a⋅ [B]в
Уравнение, отражающее зависимость скорости реакции от концентраций реагирующих веществ, называется кинетическим уравнением реакции.
Множитель k в этом уравнении показывает скорость химической реакции при концентрациях реагирующих веществ, равных 1 моль/л, называется константой скорости химической реакции. Она не зависит от концентрации и характеризует влияние природы реагирующих веществ на скорость их взаимодействия друг с другом. Из этого следует, что константа скорости реакции является мерой реакционной способности молекул.
Показатели степени а и b называются порядком реакции по данному веществу. Сумма (а + b) — общий порядок реакции. Порядок реакции - величина формальная. Может быть положительной, отрицательной, целым, дробным, нулевым числом. Порядок реакции определяется экспериментально, его нельзя предсказать заранее.
Для многих химических реакций порядок реакции по данному вещеcтву не равен стехиометрическому коэффициенту.
Период полупревращения (период полураспада).
Период полупревращения — это время, в течение которого прореагирует половина исходного вещества в химической реакции (t1/2).
T0.5= ;
;
Нулевой:: v = k
Первый: v = kC^1
Второй: v = k2C^2
Чем выше концентрация, тем больше скорость реакции, Эта зависимость выражается законом действующих масс сформулированном в 1867 г. норвежскими учеными К. Гульдбергом и П. Вааге: скорость простой реакции в каждый момент времени пропорциональна произведению концентраций реагирующих веществ, воз-веденных в степени, равные коэффициентам в стехиометрическом уравнении.
7. Зависимость скорости реакции от температуры. Температурный коэффициент реакции и его особенности для биохимических процессов. уравнение Аррениуса.Правило Вант-Гоффа: при повышении температуры на 10 градусов скорость гомогенной хим.реакции увеличивается в 2-4 раза.
![]()
где
V2
— скорость реакции при температуре Т2,
V1—
скорость реакции при температуре Т1,
![]() —
температурный коэффициент реакции
(если он равен 2, например, то скорость
реакции будет увеличиваться в 2 раза
при повышении температуры на 10 градусов).
Из уравнения Вант-Гоффа температурный
коэффициент вычисляется по формуле:
—
температурный коэффициент реакции
(если он равен 2, например, то скорость
реакции будет увеличиваться в 2 раза
при повышении температуры на 10 градусов).
Из уравнения Вант-Гоффа температурный
коэффициент вычисляется по формуле:
![]()
Теория активных соударений обобщает закономерности зависимости скорости хим.р-и от температуры:1.Реагировать могут не все молекулы, а только находящиеся в особом активном состоянии2.Активация молекулы происходит в результате биомолекулярного столкновения. 3.При столкновении частиц с примерно одинаковым запасом энергии происходит её перераспределение, в результате чего энергия одной из молекул достигает значения, соответствующего энергии активации.4.Влияние температуры на скорость реакции: смещение равновесия между обычными и активными молекулами в сторону увеличения концентрации первых.
Энергетический профиль реакции (график зависимости потенциальной энергии от координаты реакции)
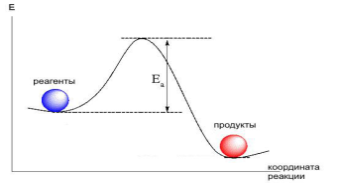
Энергия активации Еа – минимальная дополнительная энергия, которую необходимо сообщить молекуле сверх среднего её значения для того, чтобы стало возможным хим. взаимодействие. Уравнение Аррениуса устанавливает зависимость константы скорости химической реакции k от температуры Т.
![]()
Здесь А характеризует частоту столкновений реагирующих молекул, R — универсальная газовая постоянная.
Роль стерического фактора заключается в том, что он учитывает то обстоятельство, что для взаимодействия сложных активных молекул необходима определенная взаимная ориентация: течению процессов способствует столкновение молекул в положениях, когда в соприкосновение приходят их реакционноспособные связи или неподеленные пары электронов.
Теория активированного комплекса ( теория переходного состояния) позволяет связать кинетику хим.реакций с термодинамическими характеристиками процесса активации дельта H и дельта S и теоретически вывести закон действующих масс для скорости простых реакций.
8. Катализ. Гомогенный и гетерогенный катализ. Осбенности каталитич.активности ферментов. Катализ-изменение скорости химических реакций в присутствии веществ, которые после завершения реакции остаются в неизменном виде и количестве. Увеличение скорости реакции называют положительным катализом, уменьшение – отрицательным катализом (или ингибированием). Катализаторами называют вещества, которые вызывают положительный катализ; вещества, замедляющие реакции – ингибиторами. Различают гомогенный и гетерогенный катализ. Ускорение реакции диспропорционирования пероксида водорода в водном растворе в присутствии дихромат-ионов является примером гомогенного катализа(катализатор образует одну фазу с реакционной смесью), а в присутствии оксида марганца(IV) – примером гетерогенного катализа(водный раствор пероксида водорода-жидкая фаза, оксид марганца-твердая). Катализаторы биохимических реакций имеют белковую природу и называются ферментами. Ферменты отличаются от обычных катализаторов рядом особенностей: 1)они обладают значительно более высокой каталитической эффективностью; 2)высокая специфичность, т.е. избирательность действия; 3)многие ферменты проявляют каталитическую активность только по отношению к одному субстрату; 4)ферменты проявляют максимальную эффективность только в мягких условиях, характеризующихся небольшим интервалом температур и значений рН. Активность фермента=Скорость реакции нулевого порядка. Энергетический профиль каталитической реакции.
9. Химическое равновесие. Обратимые и необратимые по направлению реакции.
Химическое равновесие: динамическое состояние, при котором скорость прямой и обратной реакций равны. Константа равновесия: при постоянных внешних условиях в равновесии отношение произведение концентраций продуктов к произведению концентраций реагентов с учетом стехиометрии есть величина постоянная, не зависящая от химического состава системы. Кс связана со стандартной Е Гиббса соотношением: Принцип Ле-Шателье: воздействие какого-либо фактора (t, c, p) на равновесную систему стимулирует смещение равновесия в таком направлении, которое способствует восстановлению первоначальных характеристик системы. Термодинамические условия равновесия: G2-G1=0 S2-S1=0
Обратимая р-ция: при данных условиях самопроизвольно протекающая как в прямом, так и в обратном направлении.
Условия протекания до конца:
- Труднорастворимый осадок
- газ
- малодиссоциирующее в-во (вода)
- устойчивое комплексное соединение
Необртаимая р-ия: при данных условия протекает в одном направление.
Положение химического равновесия зависит от следующих парамктров реакции: температуры, давления и концентрации. Влияние, которое оказывают эти факторы на химическую реакцию, подчиняются закономерности, которая была высказана в общем виде в 1884 году французским ученым Ле-Шателье. Современная формулировка принципа Ле-Шателье такова:
Если на систему, находящуюся в состоянии равновесия, оказать внешнее воздействие, то система перейдет в другое состояние так, чтобы уменьшить эффект внешнего воздействия.
Если н |
Стационарное состояние - в физике, состояние физ. системы, при к-ром нек-рые существенные для хар-ки системы величины (разные в разных случаях) не меняются со временем. Напр., состояние потока жидкости стационарно, если скорость движения (и др. хар-ки) остаётся в каждой точке пр-ва неизменной.
Влияние температуры зависит от знака теплового эффекта реакции. При повышении температуры химическое равновесие смещается в направлении эндотермической реакции, при понижении температуры — в направлении экзотермической реакции.
Влияние давления.При повышении давления равновесие сдвигается в направлении, в котором уменьшается суммарное количество молей газов и наоборот.
Влияние концентрации. При повышении концентрации одного из исходных веществ равновесие сдвигается в направлении образования продуктов реакции. При повышении концентрации одного из продуктов реакции равновесие сдвигается в направлении образования исходных веществ.
