
- •Метаболиты мевалоновой кислоты (лекция 2)
- •Номенклатура стероидов (Лекция 3)
- •Связь холестерина с другими стероидами (Лекция 5)
- •Метаболиты аминокислот (Лекция 6)
- •Биосинтез 3,4-диоксифенилаланина (дофа) (Лекция 7)
- •Модифицированные производные l-дофа, как пример использования структурной аналогии при создании лекарственных средств (Лекция 8)
- •Меланины (Лекция 9)
- •Метаболизм ароматических соединений (Лекция 10)
- •Антибиотики пенициллинового ряда (Лекция 11)
- •Цефалоспорины (Лекция 12)
- •Незаменимые жирные кислоты
- •Биосинтез полиеновых кислот
- •Химический синтез арахидоновой кислоты
- •Простагландины и тромбоксаны
Меланины (Лекция 9)
Диоксифенилаланин (ДОФА) в присутствии кислорода быстро темнеет. Процесс сильно ускоряется под действием тирозиназы, катализирующей также окисление тирозина в ДОФА. У животных тирозиназа обнаруживается только в органеллах, называемых меланосомами, которые находятся в меланоцитах – особых клетках, синтезирующих меланин. Пигменты образуются в результате последовательных реакций ферментативного и неферментативного окисления, декарбоксилирования и конденсации. Начальные стадии изображены процесса приведены на схеме:
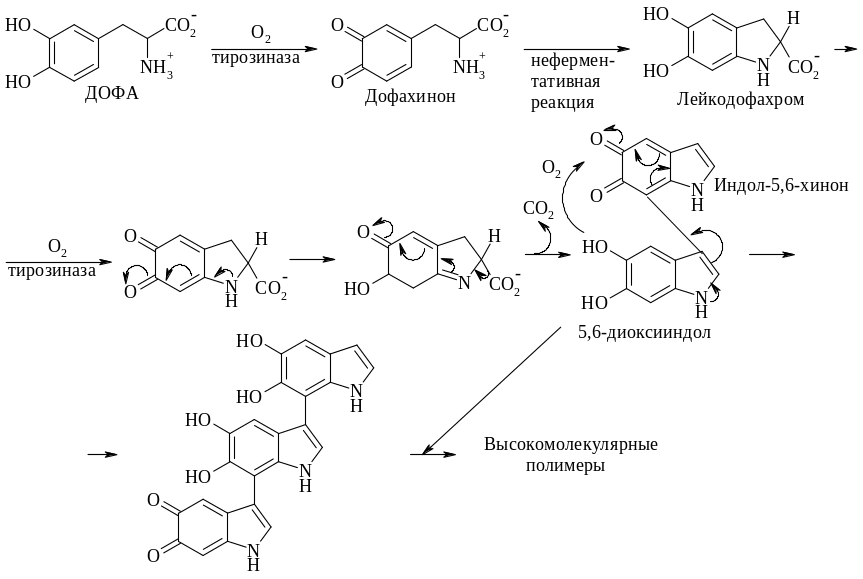
Вслед за окислением ДОФА в дофахинон происходит внутримолекулярная реакция присоединения в сочетании с таутомеризацией молекулы в производное индола – лейкодофахром. За вторым окислением под действием тирозиназы следуют декарбоксилирование и таутомеризация в 5,6-диоксииндол. Последний может подвергаться третьей реакции окисления в индол-5,6-хинон. В результате конденсации двух последних продуктов образуется димер, к которому могут окислительным путем присоединяться дальнейшие диоксииндольные звенья с образованием в конечном итоге высокополимерного соединения. Родственная серия красных полимеров, присутствующих в рыжих волосах и перьях, образуется путем присоединения цистеина к дофахинону.
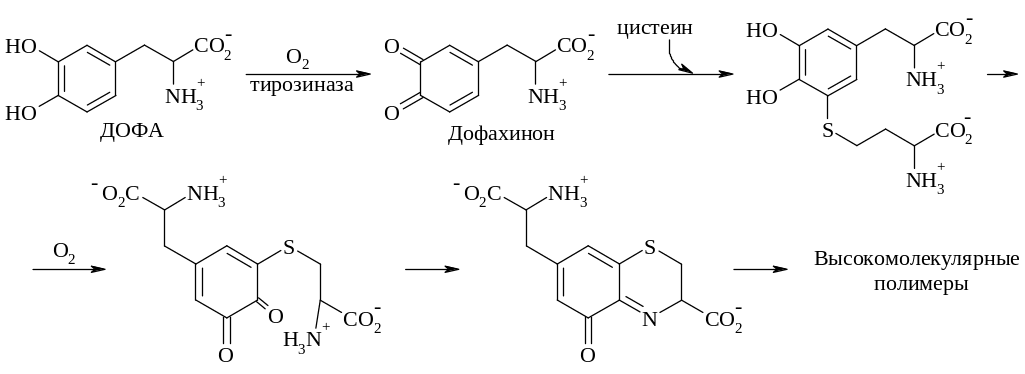
Присоединение цистеина может происходить по нескольким положениям. Образующиеся в результате аддукты (показан лишь один) могут подвергаться окислительной циклизации, как указано на приведенном рисунке.
МЕТАБОЛИЗМ ФЕНИЛАЛАНИНА И ТИРОЗИНА У РАСТЕНИЙ
Некоторые пути метаболизма этих аминокислот, функционирующие у животных и бактерий, используются также и растениями. Однако у растений наиболее важную роль играют реакции, инициируемые фенилаланин-аммиак-лиазой и тирозин-аммиак-лиазой. На следующей схеме показан основной путь, ведущий к превращению этих двух аминокислот в транс-коричную кислоту и в ее моно-, ди- и триоксипроизводные.

Циннамоил-СоА служит источником образования антоцианинов, а также других флавоноидных пигментов и полимерных конденсированных таннинов. Диокси- и триоксиметилированные продукты являются исходным материалом для образования лигнинов. Кроме того, из этих общих предшественников образуется ряд других продуктов, обусловливающих характерный запах некоторых растений, а также различных специй.
ЛИГНИН
Лигнин представляет собой материал очень сложного состава с молекулярным весом более 10000. Он на редкость устойчив и не растворяется даже в горячей 70%-ной серной кислоте. Лигнин часто описывают как «статистический полимер, построенный из оксифенилпропановых звеньев». Он образуется путем окислительной конденсации кониферилового спирта и родственных мономеров. Ферментом, ответственным за полимеризацию, может быть пероксидаза, катализирующая образование лигнина из мономерных спиртов и Н2О2. Радикал, образующийся при удалении электрона из фенолят-аниона кониферилового спирта:
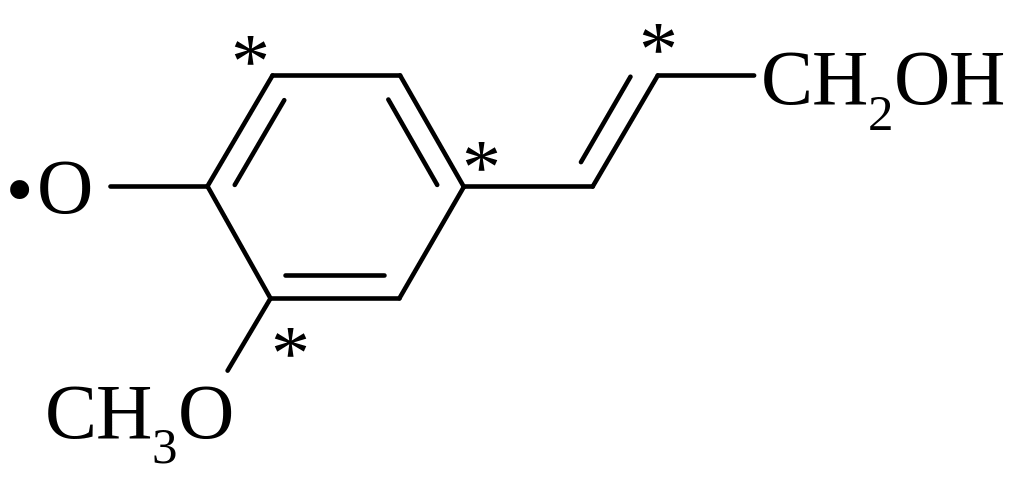
существует во множестве резонансных состояний, в которых неспаренный электрон может локализоваться не только на кислороде, но и в положениях, отмеченных звездочками.
Конденсация таких радикалов дает начало большому ряду соединений. Например, в результате димеризации образуется устойчивая структура с эфирными связями:
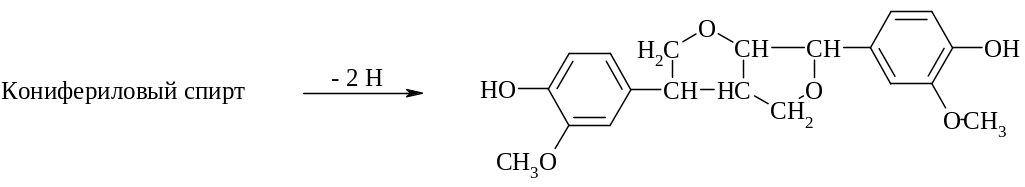
Образующийся димер все еще содержит гидроксильные группы, способные к переходу в радикалы и присоединению следующих звеньев. Имеется еще не менее десяти других типов межмолекулярных связей. Лигнин представляет исключительную ценность как потенциальный источник сырья, используемого для промышленного получения ароматических соединений. Однако пока в его утилизации существенных успехов не достигнуто.
Окислительное разрушение лигнина приводит к образованию гуминовых кислот, являющихся важным органическим компонентом почв.
АЛКАЛОИДЫ
Идентифицировано свыше 2500 алкалоидов – различных азотсодержащих соединений, образующихся у растений. Особенно много различных алкалоидов образуется у растений определенных семейств. Алкалоиды часто рассматривают как конечные продукты азотистого метаболизма у растений. Однако большинство растений вообще не содержит алкалоидов, и тот факт, что у некоторых растений они образуются, возможно, связан с экологическими причинами. Большинство алкалоидов обладают биологической активностью – оказывают выраженное действие на организм животных.
Значительная часть алкалоидов образуется непосредственно из ароматических аминокислот. Впервые это установил Робинсон, который предположил, что алкалоиды могут синтезироваться в результате реакций Манниха из аминов и альдегидов.
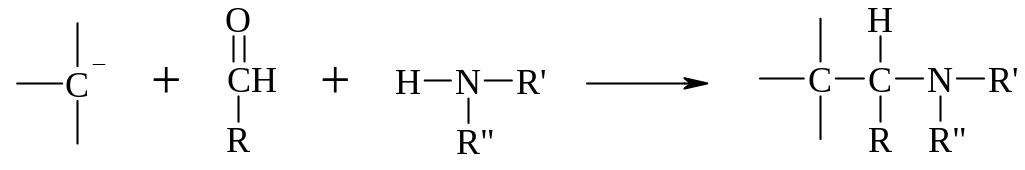
В реакции Манниха амин и альдегид (вероятно, образуя основание шиффа) реагируют с нуклеофильным углеродом, таким, как углерод енолят-аниона. Декарбоксилирование аминокислот может привести к появлению различных аминов, а альдегиды могут быть образованы окислительным декарбоксилированием аминокислот (проходящим через переаминирование и -декарбоксилирование). Таким образом, аминокислоты могут дать начало обоим главным реагентам, используемым в биосинтезе алкалоидов. Далее нуклеофильные центры ароматических колец, в частности находящиеся в пара-положении относительно гидроксильных заместителей, часто участвуют в конденсации Манниха в биосинтетических путях. Например:
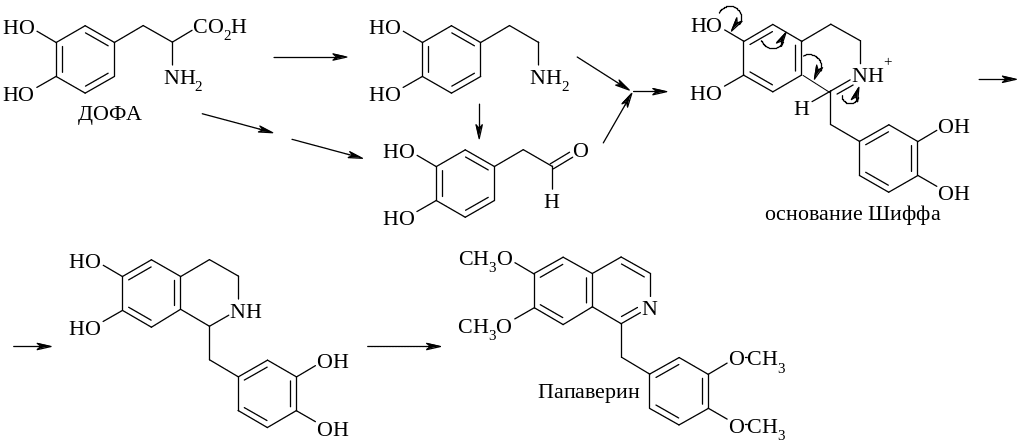
ДОФА декарбоксилируется, превращаясь в дофамин, который окисляется в 3,4-диоксифенилацетальдегид. Реакция Манниха через промежуточное образование основания Шиффа приводит к циклизации. В результате окисления цикла образуется изохинолиновое ядро – характерный структурный элемент большой группы алкалоидов. Метилирование приводит к образованию папаверина, образующегося в снотворном маке. Родственный ему алкалоид морфин на первый взгляд не имеет с ним никакого сходства. Однако при более внимательном рассмотрении очевиден прямой путь биосинтеза морфина.
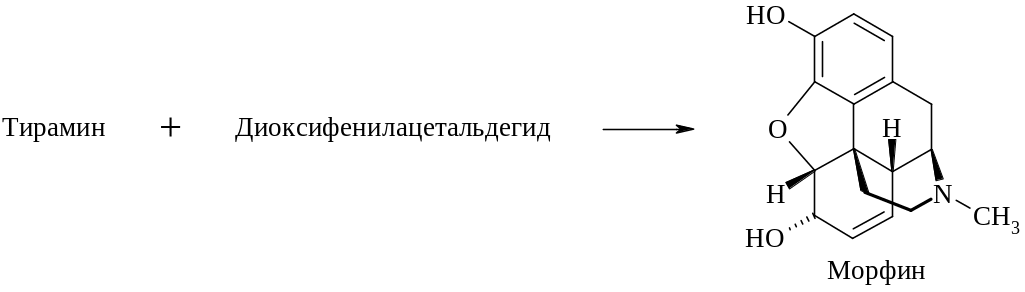
По существу это конденсация, аналогичная той, что ведет к образованию папаверина, но в данном случае вместо дофамина в реакции участвует тирамин. Далее два цикла претерпевают окислительную конденсацию посредством одной связи С–С и одной эфирной связи.
Еще одним алкалоидом, образующимся из фенилаланина и тирозина, является колхицин (В медицинской практике колхицин используют для лечения подагры (для уменьшения боли)):

Шестичленное кольцо которого образуется из фенилаланина, а семичленный трополоновый цикл образуется путем расширения ядра тирозина.
Хотя идеи Робинсона о биосинтезе алкалоидов первоначально носили чисто умозрительный характер, затем они нашли экспериментальное подтверждение в опытах с использованием изотопных меток. Тем не менее, остается много нерешенных вопросов. Среди промежуточных соединений не оказалось постулированных альдегидов. Возможно, конденсация Манниха происходит при участии кетокислот, предшествуя декарбоксилированию.
