
- •Метаболиты мевалоновой кислоты (лекция 2)
- •Номенклатура стероидов (Лекция 3)
- •Связь холестерина с другими стероидами (Лекция 5)
- •Метаболиты аминокислот (Лекция 6)
- •Биосинтез 3,4-диоксифенилаланина (дофа) (Лекция 7)
- •Модифицированные производные l-дофа, как пример использования структурной аналогии при создании лекарственных средств (Лекция 8)
- •Меланины (Лекция 9)
- •Метаболизм ароматических соединений (Лекция 10)
- •Антибиотики пенициллинового ряда (Лекция 11)
- •Цефалоспорины (Лекция 12)
- •Незаменимые жирные кислоты
- •Биосинтез полиеновых кислот
- •Химический синтез арахидоновой кислоты
- •Простагландины и тромбоксаны
Связь холестерина с другими стероидами (Лекция 5)
Cтероидные гормоны млекопитающих играют важную биологическую роль в их жизнедеятельности, поэтому их изучению посвящены многочисленные работы. Эта область знаний широка и разнообразна, поэтому рассмотрим только те пути, которые составляют часть трехмерной карты метаболизма стероидов.
Начальные этапы включают деградацию боковой цепи холестерина (44):
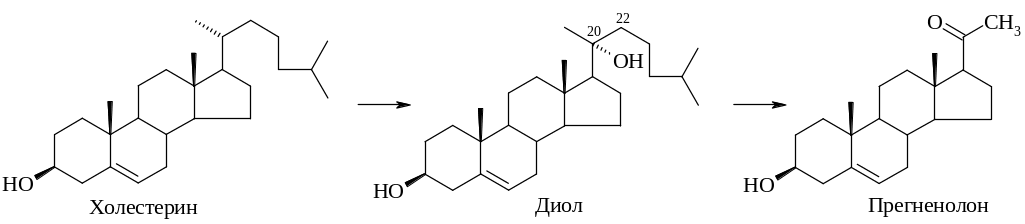
путем введения в С-20α гидроксильной группы образуется диол, последующее окисление при С-22 и расщепление связи С20–С22 приводит к образованию прегненолона и изогексанвой кислоты.
Образовавшийся прегненолон далее превращается в кортикостероиды:
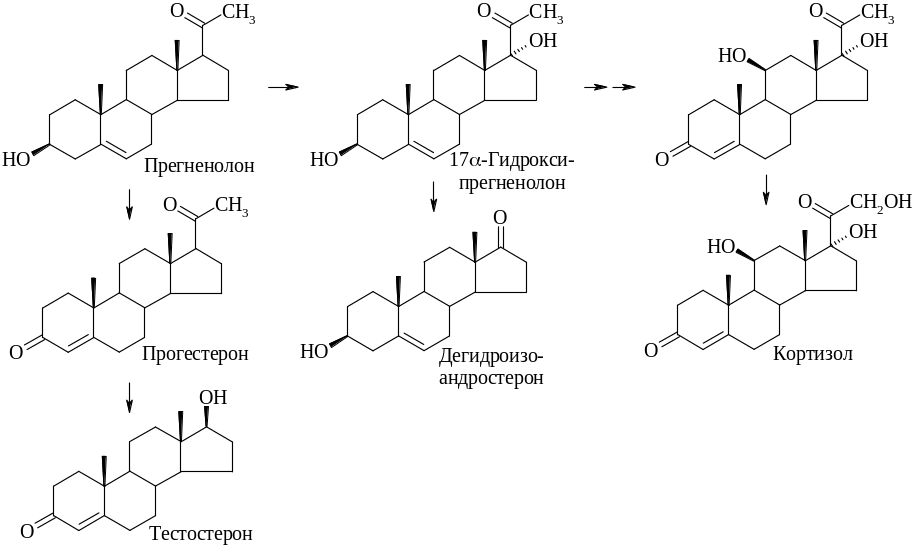
окисляясь сначала до прогестерона, а затем, окисляясь по атомам С-17, С-21 и С-11, образует, например, кортизол. Отмечалось, что в некоторых системах прегненолон гидроксилируется по С-17 с образованием 17α-гидроксипрегненолона прежде, чем происходит окисление кольца А в α,β-ненасыщенный кетон. 17α-Гидроксипрегненолон может также превращаться в C19-стероид (дегидроизоандростерон), в то время как прогестерон превращается под действием 17β-десмолазы в тестостерон.
Так же подробно исследовано превращение тестостерона и андростен-4-диона-3,17 в эстрон.
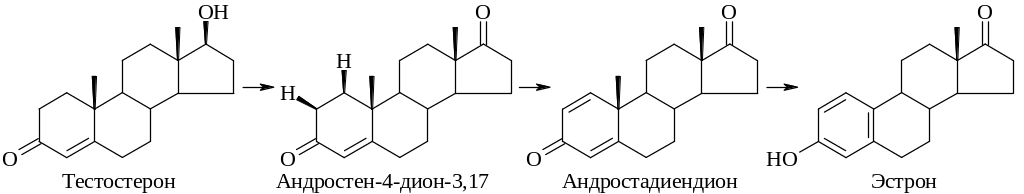
Дегидрирование, приводящее к андростадиендиону, связано с потерей 1β- и 2β-протонов. Гидроксилирование по С-19 может происходить как до, так и после дегидрирования, за которым следует окисление и элиминирование атома С-19 в виде муравьиной кислоты.
Простой и короткий синтез эстрона разработан Торговым и Ананченко в 1962 г. Синтез может конкурировать с биосинтезом.
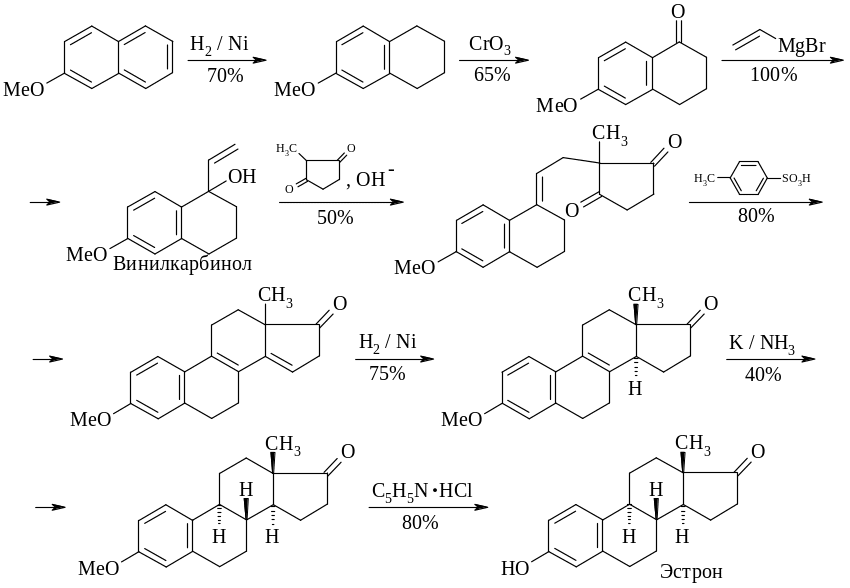
Исходным веществом, являющимся основой колец А и В стероидной молекулы, служит 6-метокситетралон-1, легко получаемый гидрированием доступного метилового эфира -нафтола и последующим окислением образовавшегося 6-метокситетралина. Из 6-метокситетралона-1 и магнийбромвинила по Гриньяру получают винилкарбинол, конденсация которого с 2-метилциклопентадионом-1,3 (основа кольца D) является ключевой стадией синтеза. Циклизацией образующегося трициклического дикетона под действием п-толуолсульфокислоты (замыкание кольца С) получают метиловый эфир бис-дегидроэстрона, который восстанавливают сначала над никелем Ренея, а затем калием в жидком аммиаке в метиловый эфир эстрона, после деметилирования которого получается эстрон.
Большим достоинством этого метода является то, что 2-метилциклопентандион-1,3 в стадии конденсации с винилкарбинолом может быть заменен производным циклогександиола-1,3. Это позволяет легко получать D-гомостероиды, синтез которых другими методами весьма сложен.
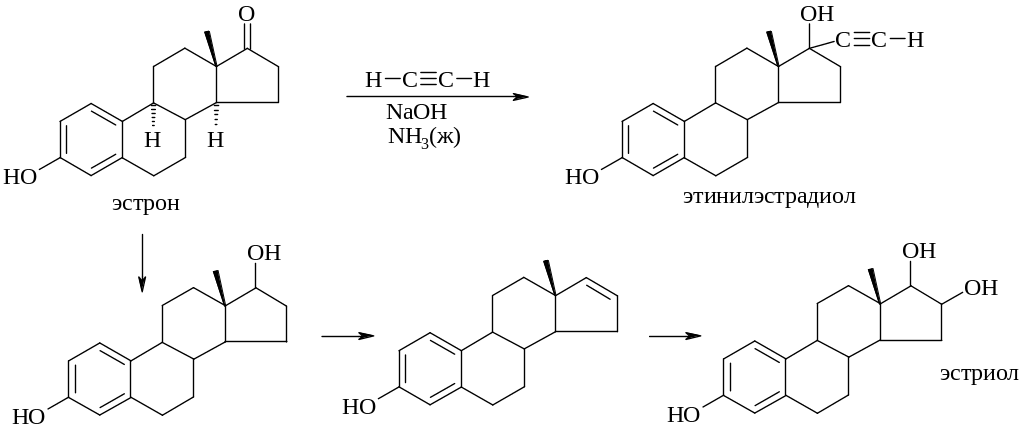
Химическая модификация эстрона, в результате которой можно получить ряд полупродуктов используемых в синтезе полусинтетических лекарственных средств можно провести по схеме:
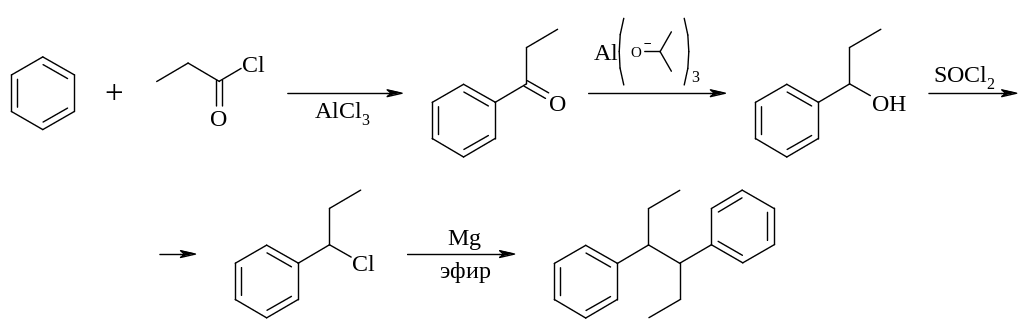
Примером удачного использования метода структурной аналогии при поиске лекарственных средств может служить синтез ряда веществ обладающих эстрогенной активностью, но не содержащих структурной основы стероидов.


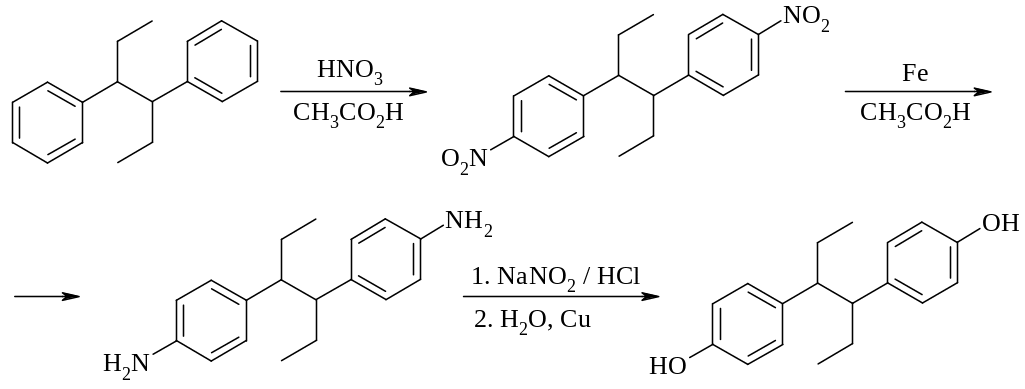
Синтез этих соединений хорошо отработан:
БИОСИНТЕЗ ЖЕЛЧНЫХ КИСЛОТ
К другому ряду метаболитов холестерина относятся желчные кислоты. Среди желчных кислот доминирует в количественном отношении холевая кислота (56). Биосинтез ее из холестерина протекает по следующей схеме:

Первым этапом биосинтеза желчных кислот является 7α-гидроксилирование холестерина и именно эта реакция является скорость-определяющей в процессе биосинтеза желчных кислот. Ее катализирует микросомальный фермент гидроксилаза-7α. Реакция протекает с участием кислорода, НАДФ и цитохрома Р-450. Фермент является типичной монооксигеназой, как и ферменты последующих стадий гидроксилирования. На следующей стадии протекает гидроксилирование при С-12, далее изменение конфигурации атома С-3 через промежуточное образование 3-кетопроизводного и насыщение 5-двойной связи путем цис-присоединения водорода к β-стороне молекулы. Деградация боковой цепи может начинаться с гидроксилирования по С-26. Затем происходит окисление атома С-24 с образованием холевой кислоты и трехуглеродного фрагмента С25–С27 который элиминируется в виде пропионил-КоА.
Путь биосинтеза желчных кислот разветвляется на ранней стадии: одна из ветвей приводит к образованию холевой кислоты, имеющей дополнительную α-ОН-группу в положении 12, а другая – к образованию хенодезоксихолевой кислоты; в остальном обе ветви сходны и включают реакции гидроксилирования и укорачивания боковой цепи, в результате образуются характерные для желчных кислот структуры, содержащие α-ОН-группы в положениях 3 и 7 и полностью насыщенное стероидное ядро.
