
- •Метаболиты мевалоновой кислоты (лекция 2)
- •Номенклатура стероидов (Лекция 3)
- •Связь холестерина с другими стероидами (Лекция 5)
- •Метаболиты аминокислот (Лекция 6)
- •Биосинтез 3,4-диоксифенилаланина (дофа) (Лекция 7)
- •Модифицированные производные l-дофа, как пример использования структурной аналогии при создании лекарственных средств (Лекция 8)
- •Меланины (Лекция 9)
- •Метаболизм ароматических соединений (Лекция 10)
- •Антибиотики пенициллинового ряда (Лекция 11)
- •Цефалоспорины (Лекция 12)
- •Незаменимые жирные кислоты
- •Биосинтез полиеновых кислот
- •Химический синтез арахидоновой кислоты
- •Простагландины и тромбоксаны
КУРС ЛЕКЦИЙ
БИООРГАНИЧЕСКИЙ СИНТЕЗ
ПРЕДМЕТ БИООРГАНИЧЕСКОЙ ХИМИИ
Биоорганическая химия изучает строение и биологические функции важнейших компонентов живой материи, в первую очередь биополимеров и низкомолекулярных биорегуляторов, уделяя главное внимание выяснению закономерностей взаимосвязи между структурой и биологическим действием. По существу она является химическим фундаментом современной биологии.
Разрабатывая основополагающие проблемы химии живого мира, биоорганическая химия способствует решению задач получения практически важных препаратов для медицины, сельского хозяйства, пищевой промышленности и ряда других отраслей народного хозяйства.
Объекты изучения: белки и пептиды, нуклеиновые кислоты, углеводы, липиды, биополимеры смешанного типа – гликопротеины, нуклеопротеины, липопротеины, гликолипиды и т.п.; алкалоиды, терпеноиды, витамины, антибиотики, гормоны, простагландины, ростовые вещества, феромоны, токсины, а также синтетические лекарственные препараты, пестициды и др.
Meтоды исследования: основной арсенал составляют методы органической химии, однако для решения структурно-фукциональных задач привлекаются и разнообразные физические, физико-химические, математические и биологические методы.
Основные задачи: выделение в индивидуальном состоянии изучаемых соединений с помощью кристаллизации, перегонки, различных видов хроматографии, электрофореза, ультрафильтрации, ультрацентрифугирования, противоточного разделения и т.п. Установление структуры, включая пространственное строение с применением масс-спектрометрии, различных видов оптической спектроскопии (ИК, УФ, лазерной и др.), рентгеноструктурного анализа, ЯМР, ЭПР, дисперсии оптического вращения и т.д. в сочетании с расчётами на ЭВМ; химический синтез и химическая модификация изучаемых соединений, включая полный синтез, синтез аналогов и производных, с целью подтверждения структуры, выяснения связи строения и биологической функции, получения практически ценных препаратов; биологическое тестирование полученных соединений in vitro и in vivo.
ИСТОРИЯ ИССЛЕДОВАНИЙ В ОБЛАСТИ БИОСИНТЕЗА
Природными соединениями называют органические вещества, находящиеся в любом живом организме. В течение последнего столетия выделено несколько тысяч таких соединений и определена их структура. Природные соединения образуются в результате метаболических процессов управляемых ферментами.
Интерес к изучению биосинтеза природных веществ развивался параллельно с накоплением данных по их строению. Уже в самых ранних работах (например, в классическом синтезе Фридрих Велер в 1828 г получил мочевину – хорошо известный продукт метаболизма животных – путем пиролитической перегруппировки цианата аммония) было показано, что в принципе природные соединения образуются в результате обычных химических реакций. Это важное открытие развеяло окружающий природные соединения миф об их сверхестественном происхождении с помощью некоей жизненной силы. Виталистическая концепция была окончательно развеяна Пастором, который в середине позапрошлого столетия показал, что микроорганизмы, в том числе бактерии и дрожжи, не возникают самопроизвольно из ничего, и что они ответственны за образование таких известных продуктов брожения, как спирт, уксусная и масляная кислоты.
С тех пор темпы работ по выделению и установлению структуры новых природных соединений, имеющих часто весьма сложное строение, все более и более ускорялись, хотя иногда выяснение полной структуры соединения затягивалось на чрезвычайно долгое время. Например, строение хорошо известного растительного алкалоида стрихнина, выделенного в 1818 г, было окончательно установлено в 1946 г. В 1964 г осуществлён полный синтез этого сложного гептациклического соединения с несколькими центрами хиральности, а за последующие годы в значительной мере выяснены пути его биосинтеза.
После 1940 г произошел качественный скачек в разработке новых методов разделения, пригодных для разделения микроколичеств близких по строению веществ.
Однако, несмотря на эти успехи в настоящее время человек располагает лишь фрагментарными данными о путях биосинтеза важнейших групп природных соединений. Хотя развитие и совершенствование методов эксперимента и приборов должно привести к повышению уровня знаний о биосинтезе вообще и о тонких деталях механизмов путей биосинтеза, в частности.
БИОСИНТЕТИЧЕСКАЯ КЛАССИФИКАЦИЯ ПРИРОДНЫХ СОЕДИНЕНИЙ.
Одним из важнейших источников органических соединений в природе является глюкоза, которая образуется в растениях и аутотрофных микроорганизмах путем восстановления CO2. Из глюкозы в результате различных ферментативных превращений образуется несколько типов универсальных биосинтетических единиц, из которых в процессе ряда последовательных катализируемых ферментами реакций формируются углеродные скелеты большинства природных соединений. Эти взаимосвязанные последовательности метаболических превращений составляют основу биосинтетической классификации, согласно которой все природные соединения несколько произвольно подразделяются на две основные группы – первичные и вторичные метаболиты.
К первичным метаболитам относят:
а) продукты общего метаболизма;
б) вещества, широко распространенные в растениях, животных и микроорганизмах, например, аминокислоты, ацетил-КоА, моносахариды, мевалоновую кислоту, нуклеотиды.
Вторичными метаболитами являются:
а) продукты специализированных путей биосинтеза;
б) соединения, образующиеся из первичных метаболитов;
в) вещества, имеющие ограниченную сферу распространения, главным образом в растениях и микроорганизмах (часто характерны для отдельного рода, вида или штамма), например, алкалоиды, терпены, фенолы, олигосахариды, флаваноиды, антибиотики.
В основу этой классификации положены в первую очередь биогенетические соображения и в меньшей степени биохимические функции рассматриваемых соединений.
К первичным метаболитам относятся также биополимеры – обычные полисахариды, белки и нуклеиновые кислоты. Небольшая часть первичных метаболитов выполняет роль предшественников для всех других природных веществ. К вторичным метаболитам относится подавляющее большинство природных соединений, которые часто имеют очень сложное строение.
Предложение классифицировать первичные и вторичные метаболиты соответственно как "биохимические реактивы" и "химические реактивы" при современном состоянии наших знаний представляется разумным.
Таблица – Биосинтетическая классификация вторичных метаболитов
Простейшие предшественники |
Вторичные метаболиты |
Аминокислоты |
Алкалоиды; производные пептидов (например, олигопептиды, дикетопиперазины и пенициллины); не содержащие азот соединения (например, производные коричной кислоты) |
Мевалоновая кислота |
Терпены, стероиды, каротиноиды и другие полиизопреноиды |
Глюкоза |
Гликозиды, модифицированные сахара (например, койевая кислота) и олигосахариды (например, стрептомицин) |
Ацетил-КоА и пропионил-КоА |
Поликетиды (производные жирных кислот, полиацетилены, макролиды и различные фенолы) |
C1-Звенья (из формиата и метионина) |
Группы -OMe, -SMe, NMe, CMe, CCH2OH и т.д. |
Вероятно, лишь малая часть природных соединений не выполняет никаких биологических функций или является просто эволюционным атавизмом; подавляющее их большинство, по-видимому, биологически важно в метаболическом, экологическом или каком-либо другом отношении. Истинная природа биологической роли вторичных метаболитов выяснится только после тщательного изучения биохимических процессов, определяющих индивидуальность видов и особей.
БИОКАТАЛИЗАТОРЫ И БИОКАТАЛИЗ
Большинство витаминов в составе ферментных систем катализируют реакции превращения аминокислот и белков, жиров, стероидов, углеводов и нуклеиновых кислот в животном организме. К таким химическим процессам относятся реакции окисления и восстановления, переноса электрона, переаминирования, трансметилирования, изомеризации, карбоксилирования, декарбоксилирования, переноса ацильных и одноуглеродных групп.
Все химические реакции в клетках животного организма протекают при невысокой температуре – в интервале от 1 до 40 °С – и идут с чрезвычайно высокой скоростью. Ускорение биохимических процессов обусловливается участием в реакциях многообразных органических биокатализаторов – ферментов и витаминов.
Витамины являются типичными биокатализаторами и, как правило, осуществляют свои каталитические функции в составе ферментных систем, находясь в животных тканях в весьма малых количествах.
Ферменты – высокомолекулярные (с молекулярной массой от 9000 до 1000000 и больше) органические вещества сложной структуры пептидной природы, их строение основано на строго последовательном чередовании и определенном разветвлении различных L-аминокислот.
Специфичность фермента к определенной химической реакции находится в связи с природой функциональных групп и типом химических связей реагирующего вещества (субстрата), его пространственной конфигурацией и характерной белковой составной частью фермента.
Основной принцип действия каждого катализатора заключается в том, что, участвуя в реакции в незначительных количествах, он образует с субстратом промежуточную активную форму, в виде которой происходит химическое превращение, причем в конце реакции катализатор регенерируется в неизменном состоянии.
В состав многих ферментов, помимо полипептидных цепей из десятков, сотен и тысяч молекул аминокислот, составляющих специфическую белковую (протеиновую) его часть, входит одна или несколько молекул относительно низкомолекулярного органического соединения небелковой природы (основания, кислоты, спирта, кетона и т. д. алифатического, алициклического или гетероциклического ряда) – так называемая простетическая группа, или кофермент. В таком случае протеиновая часть фермента называется апоферментом. В состав некоторых ферментов также входят неорганические кофакторы – ионы металлов Fe, Co, Сu, Мn и др.
В качестве коферментов к настоящему времени известны следующие вещества:
Убихинон (кофермент Q)
Липоевая кислота
Порфирины
D-Глюкозо-1,6-дифосфат
D-Маннозо-1,6-дифосфат
Аденозин-5'-ди (три) фосфат
Гуанозин-5'-ди (три) фосфат
Уридин-5'-ди (три) фосфат
Цитидин-5'-ди (три) фосфат
Инозин-5'-ди (три) фосфат
Уридиндифосфатсахара (с углеводами: глюкозой, галактозой, арабинозой, ксилозой, глюкуроновой кислотой)
Гуанозиндифосфатсахара (с углеводами: фруктозой, маннозой)
Цитидиндифосфатспирты (со спиртами: рибитом, этаноламином, глицерином, холином)
S-Аденозилметионин
Глутатион (-L-глутамин-L-цистеинилглицин)
Ациладенилаты
Различные производные витаминов и др.
Коферменты – производные витаминов:
Кофермент А (КоА)
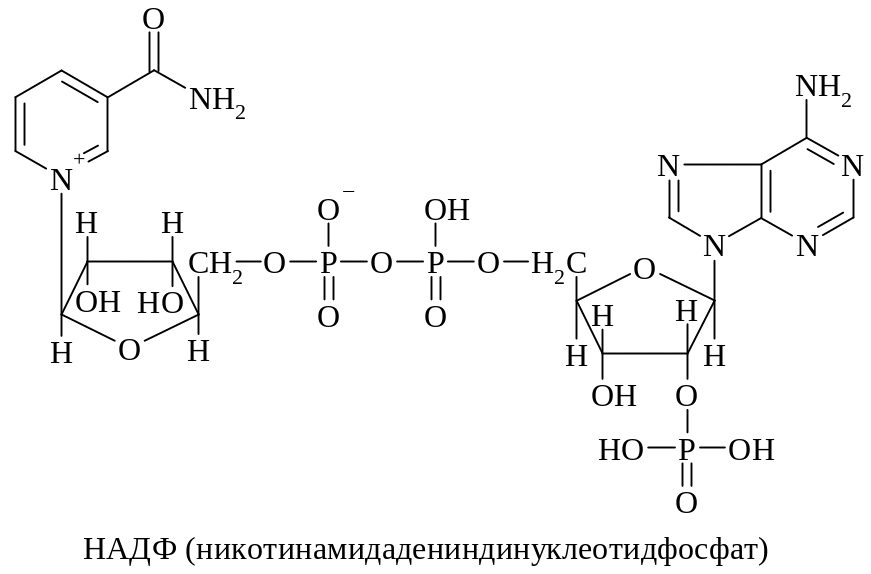
Никотинамидадениндинуклеотид (НАД)
Никотинамидадениндинуклеотидфосфат (НАДФ)
Пиридоксаль-5-фосфат
Пиридоксамин-5-фосфат
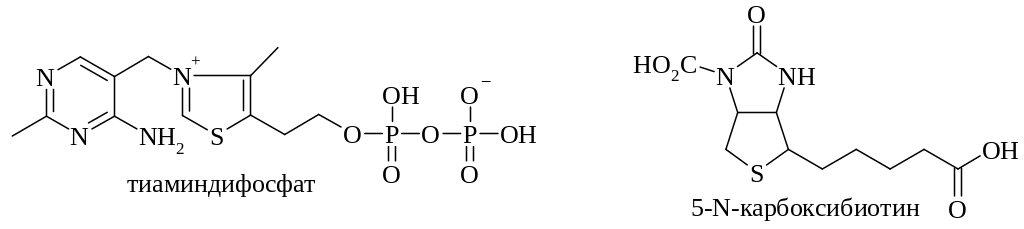
Тиаминпирофосфат (тиаминдифосфат, ТДФ)
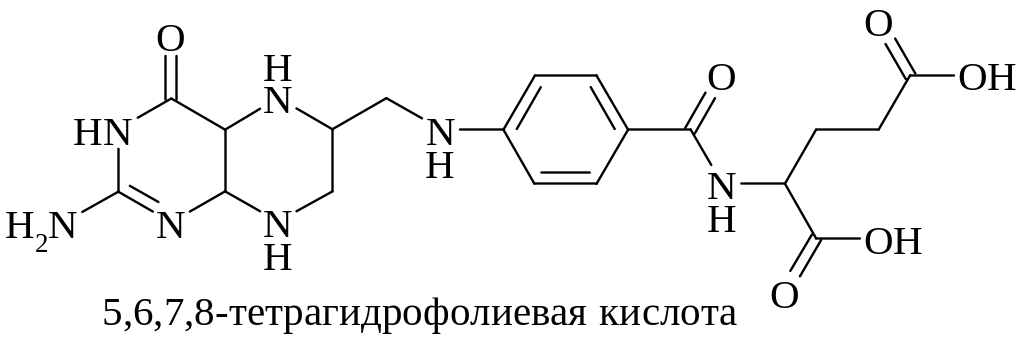
5,6,7,8-Тетрагидрофолиевая кислота
5-N-Карбоксибиотин
Флавинмононуклеотид (рибофлавин-5'-фосфат, ФМН)
Флавинадениндинуклеотид (ФАД)
Гистидилфлавинадениндинуклеотид (8-гистидил-ФАД)
Цистеинилфлавинадениндинуклеотид (8-цистеинил-ФАД)
Кофермент-кобаламин (5'-дезоксиаденозилкобаламин)
Группа нуклеотидных коферментов производных витаминов (КоА, НАД, НАДФ, ФАД и др.) представляет собой смешанный ангидрид Р1, Р2-диэфиров пирофосфорной кислоты. В своей структуре они имеют витамин, соединенный β-гликозидной связью с D-рибофуранозой (нуклеозид) и по первичной гидроксильной группе этерифицированный ортофосфорной кислотой (нуклеотид); эта часть молекулы пирофосфатной связью объединяется с аденозин-5'-фосфатом.
Номенклатура коферментов установлена Международным союзом по чистой и прикладной химии.
Кофермент обусловливает каталитические функции в химической реакции.
Сам каталитический акт химической реакции происходит в фермент-субстратном комплексе, состоящем из субстрата и активного центра фермента, образованного из определенных функциональных групп аминокислот, кофермента, иногда ионов металла, строго фиксированных в пространстве.
Химическая связь кофермента (простетической группы) с ферментным белком осуществляется по-разному. Связь с апоферментом может быть ковалентной, трудно расщепляемой, в этом случае простетическая группа в каталитическом акте во все время реакции тесно связана с белком. Связь с ферментным белком может быть ионной, водородной или иной, легко диализуемой, например НАД и алкогольдегидрогеназы; в этом случае кофермент в каталитическом акте переходит от одного ферментного белка к другому.
В отсутствие белка фермента кофермент не проявляет или почти не проявляет биологической каталитической активности.
Апофермент – протеиновая часть фермента – синтезируется из L-аминокислот самим организмом. Витамин же поступает с пищей и превращается в кофермент в печени, крови или других органах и тканях.
Строение коферментов, производных витаминов:

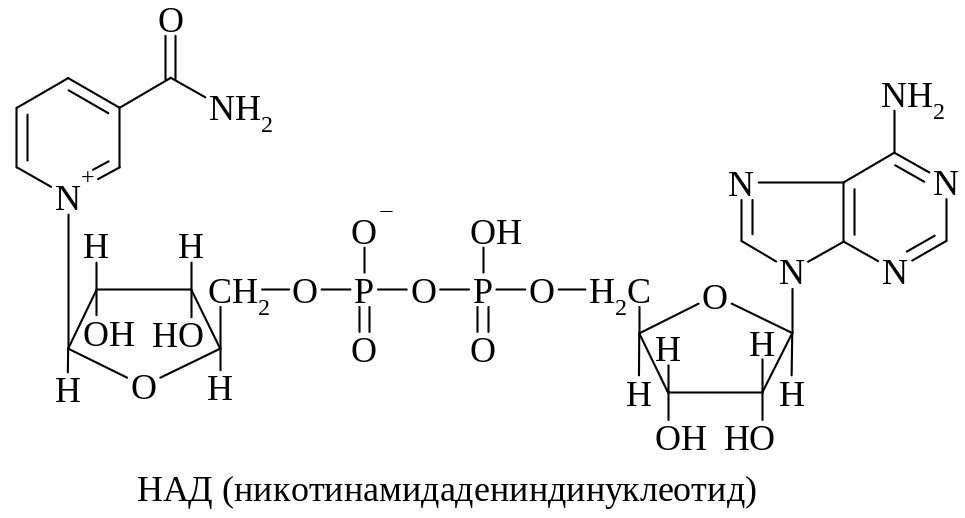


Метаболиты мевалоновой кислоты (лекция 2)
Полиизопреноидный характер терпенов и стеринов, впервые отмеченный Ружичкой в 1922 г, показан на примере различных грибных изопреноидов. Простой сесквитерпен ипомеамарон:

образуется из общего предшественника всех триизопреноидов – фарнезилпирофосфата, а дитерпен маноилоксид (10),

вероятно, синтезируется из соответствующего промежуточного тетраизопреноида геранилгеранилпирофосфата, претерпевающего ряд реакций циклизации, не осложненных столь обычными в случае других терпенов перегруппировками. Эхинулин (11) служит примером соединений смешанного биосинтетического происхождения;

его относительно сложная структура легко поддается структурному анализу, показавшему, что он образуется из триптофана, аланина и трех изопреновых звеньев.
Природа моноизопреноидных промежуточных соединений изопентенилпирофосфата (14) и диметилаллилпирофосфата (15)
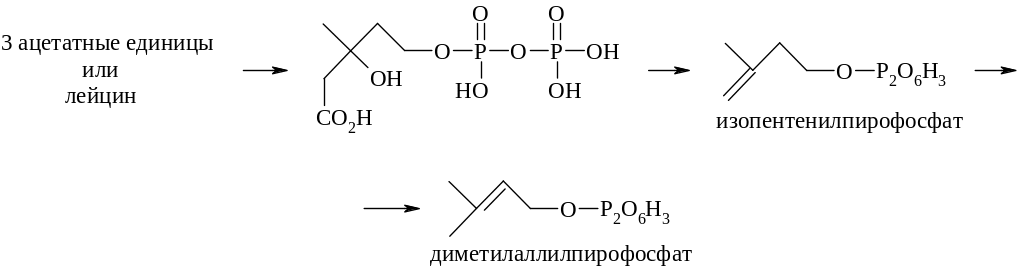
была выяснена только после идентификации их общего биосинтетического предшественника – мевалоновой кислоты.
Мевалоновая кислота довольно неожиданно была открыта в 1956 г микробиологами, которые хотели идентифицировать вещество, заменявшее ацетат в качестве фактора роста бактерий. Обычно мевалоновая кислота образуется при конденсации трех молекул ацетилкофермента А.
ОБРАЗОВАНИЕ МЕВАЛОНОВОЙ КИСЛОТЫ
Центральным метаболитом в биосинтезе мавалоновой кислоты является 3-гидрокси-метилглутарил-КоА. Образование мевалоновой кислоты начинается с конденсации молекул ацетил-КоА и ацетоацетил-КоА. На первой стадии образуется молекула 3-гидрокси-3-метилглутарил-КоА.
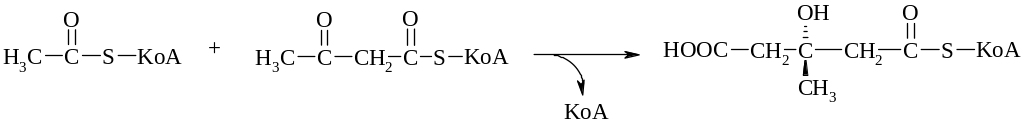
Реакция катализируется ферментом ацетилтрансферазой.
Далее происходит НАДФ-зависимое восстановление 3-гидрокси-3-метилглутарил-КоА в мевалоновую кислоту
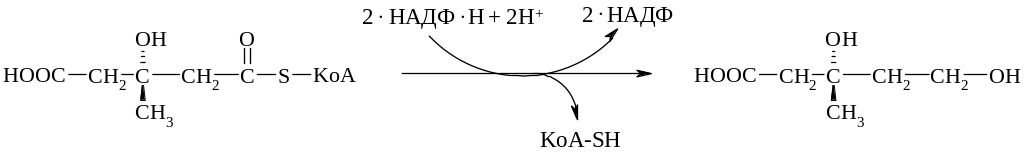
Существуют и другие пути биосинтеза мевалоновой кислоты
ПРЕВРАЩЕНИЕ МАВАЛОНОВОЙ КИСЛОТЫ В ИЗОПРЕНОИДНЫЕ ЕДИНИЦЫ.
Изопреноидные фрагменты, которые можно рассматривать как строительные блоки при синтезе терпенов и, в частности, холестерина, образуются из мевалоновой кислоты за счет АТФ-зависимого фосфорилирования и декарбоксилирования.
На первом этапе мевалоновая кислота фосфорилируется с образованием 5-фосфомевалоновой кислоты
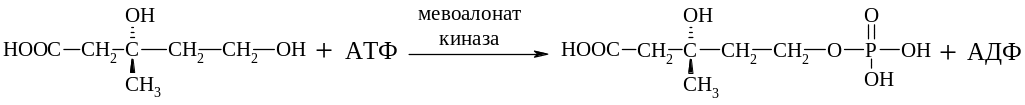
Далее на 5-фосфомевалоновую кислоту переносится еще одна фосфатная группа от АТФ с образованием 5-дифосфомевалоновой кислоты
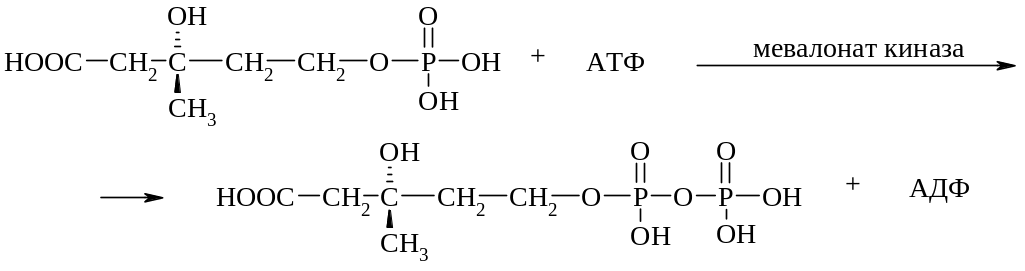
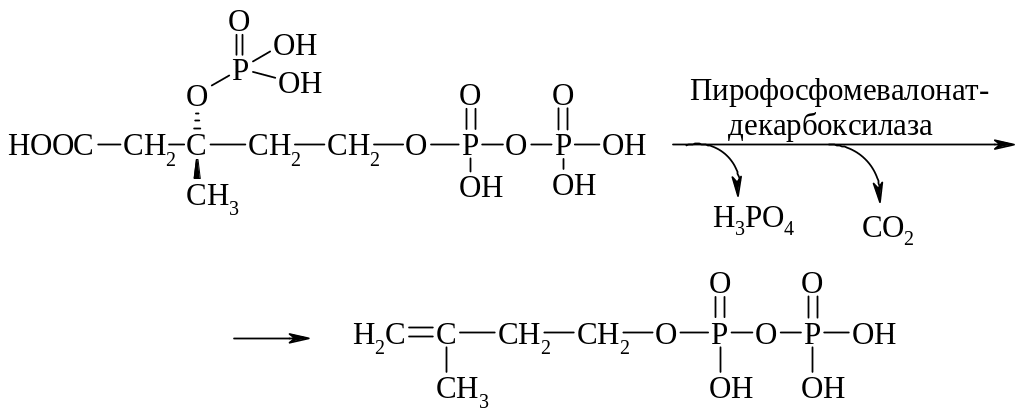
5-Дифосфомевалоновая кислота является акцептором еще одной фосфатной группы. При этом образуется нестабильный промежуточный продукт 3-фосфо-5-дифосфомевалоновая кислота:

которая подвергается дефосфорилированию и декарбоксилированию с образованием 3-изопентенилдифосфата:
В реакции изомеризации 3-изопентенилдифосфат может превратиться в 3,5-диметил-аллилдифосфат:

КОНДЕНСАЦИЯ ИЗОПРЕНОИДНЫХ ЕДИНИЦ В СКВАЛЕН
На первой стадии изопентенилдифосфат взаимодействует с 3,5-диметилаллилдифосфатом с образованием соединения состоящего из 10 атомов углерода – геранилдифосфата.
Далее геранилдифосфат конденсируется с одной молекулой изопентенилдифосфата, что приводит к образованию фарнезилдифосфата – соединения, состоящего из 15 атомов углерода.
На последней стадии две молекулы фарнезилдифосфата, взаимодействуя между собой, образуют молекулу сквалена.

В отличие от большинства других изученных групп природных соединений, к полиизопреноидам относится значительное число продуктов метаболизма животных: от хорошо известных стероидов, например холестерина, обнаруженного у высших животных, до иридоидов (циклопентаноидных монотерпенов) муравьев, например иридодиаля (24).

В морских организмах обнаружены галогенсодержащие вещества необычного строения, например монотерпен виолацен (29).

Осложнения, которые возникают в результате образования углерод-углеродных связей и молекулярных перегруппировок, можно хорошо проиллюстрировать на примере синтеза холестерина.
БИОСИНТЕЗ ХОЛЕСТЕРИНА
Биогенетическая взаимосвязь сквалена и холестерина предполагалась еще до 1926 г., однако достоверно участие сквалена в образовании углеродного скелета холестерина было установлено лишь в 1953 г после того, как было выяснено распределение радиоактивной метки в холестерине, образующемся из меченого ацетата и мевалоната.
Первоначально предполагалось, что биологическая циклизация сквалена с образованием ланостерина инициируется атакой формального катиона ОН+.

В 1966 г. Кори и Ван Тамелен обнаружили еще один промежуточный продукт в биосинтезе стеринов – 2,3-эпоксисквален. Было показано, что это соединение играет принципиальную роль в образовании многих тритерпенов. Этот эпоксид обнаружен во многих растениях, а превращение сквалена в тетрациклический стерин протекает под действием двух ферментных комплексов – эпоксидазы и циклазы.
Образование ланостерина и его дальнейшее превращение в холестерин тщательно изучались многие годы. Было высказано предположение что циклизация приводит к образованию протоланостеринового карбениевого иона, который может стабилизоваться на поверхности фермента. Затем следует ряд миграций атомов водорода и метильных групп, которые завершаются потерей водородного атома при С-9 и образованием ланостерина.
Превращение ланостерина в холестерин
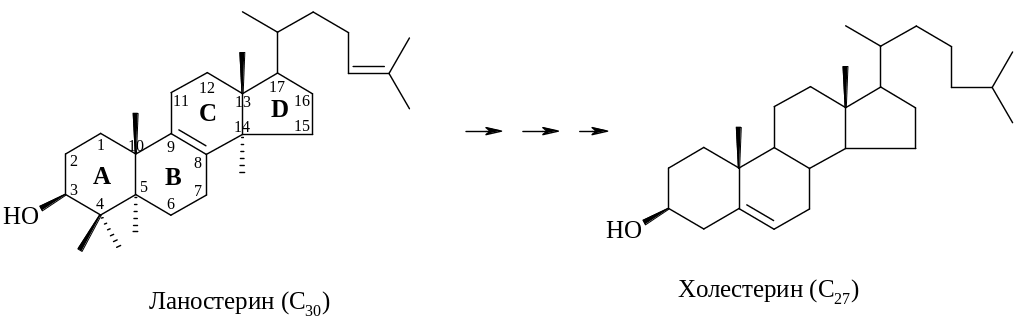
включает потерю трех метильных групп, восстановление двойной связи в боковой цепи и миграцию 8,9-двойной связи в 5,6-положение. Во время превращения ланостерина в холестерин метильные группы при С-4 элиминируются в виде диоксида углерода, а метильная группа при С-14 – в виде муравьиной кислоты.
